
【題目】如圖所示的電解裝置中,A池盛有200mL飽和KCl溶液,B池盛有200ml飽和CuSO4溶液,四個電極都用惰性材料制成,通電一段時間后,B池中陰極增重0.64g,求:
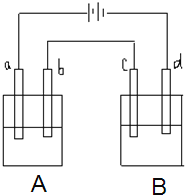
(1)寫出A、B兩池中陽極電極反應式________。
(2)計算標準狀況下氣體各為多少升?_________。
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物說法正確的是( )
A.可用酸性高錳酸鉀溶液鑒別乙醇、環(huán)己烯與溴苯
B.![]() 是由小分子CH2==CH—CH3 和CH2==CH2 發(fā)生加聚反應的產物
是由小分子CH2==CH—CH3 和CH2==CH2 發(fā)生加聚反應的產物
C.石油裂解和油脂皂化都是由高分子化合物生成小分子物質的過程
D.淀粉與纖維素互為同分異構體,二者水解的最終產物相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖像分別表示有關反應的反應過程與能量變化的關系。
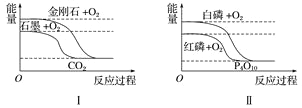
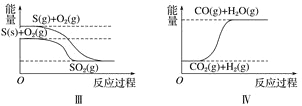
據(jù)此判斷下列說法中正確的是( )
A. 石墨轉變?yōu)榻饎偸俏鼰岱磻?/span> B. 白磷比紅磷穩(wěn)定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 則ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用乙醇、濃硫酸和溴化鈉反應來制備溴乙烷,其反應原理為H2SO4(濃)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有關數(shù)據(jù)和實驗裝置如(反應需要加熱,圖中省去了加熱裝置):
CH3CH2Br+H2O。有關數(shù)據(jù)和實驗裝置如(反應需要加熱,圖中省去了加熱裝置):
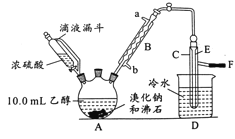
乙醇 | 溴乙烷 | 溴 | |
狀態(tài) | 無色 液體 | 無色 液體 | 深紅棕色 液體 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸點/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中進水口為__口(填“a”或“b”)。
(2)實驗中用滴液漏斗代替分液漏斗的優(yōu)點為__。
(3)氫溴酸與濃硫酸混合加熱發(fā)生氧化還原反應的化學方程式__。
(4)給A加熱的目的是__,F接橡皮管導入稀NaOH溶液,其目的是吸收__和溴蒸氣,防止__。
(5)C中的導管E的末端須在水面以下,其原因是__。
(6)將C中的鎦出液轉入錐形并瓶中,連振蕩邊逐滴滴入濃H2SO41~2mL以除去水、乙醇等雜質,使溶液分層后用分液漏斗分去硫酸層;將經(jīng)硫酸處理后的溴乙烷轉入蒸鎦燒瓶,水浴加熱蒸餾,收集到35~40℃的餾分約10.0g。
①分液漏斗在使用前必須__;
②從乙醇的角度考慮,本實驗所得溴乙烷的產率是__(精確到0.1%)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據(jù)原子結構及元素周期律的知識,下列推斷正確的是( )
A.同主族元素含氧酸的酸性隨核電荷數(shù)的增加而減弱
B.核外電子排布相同的微粒化學性質也相同
C.Cl-、S2-、Ca2+、K+半徑逐漸增大
D.![]() Cl與
Cl與![]() Cl得電子能力相同
Cl得電子能力相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,彼此之間關系正確的是
A. C(金剛石)與C(石墨)屬于同位素
B. CH2=CH2和CH2=CH-CH=CH2屬于同系物
C. CH3CH(CH3)2和CH4屬于同系物
D. ![]() 與
與![]() 是同分異構體
是同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化氫毒性很大,俗稱“一口悶”,工業(yè)廢水中的硫化物在酸性條件下會以硫化氫的形式逸出。某課外小組以碘量法測定廢水中的硫化物,實驗裝置如圖所示,實驗步驟及測定原理如下:
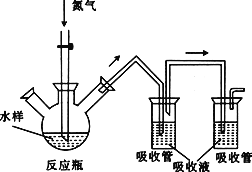
Ⅰ.取樣、吹氣、固硫
連接裝置,打開氮氣源,檢查裝置氣密性。移取一定體積1mol·L-1乙酸鋅溶液于兩支吸收管中,取200mL水樣于反應瓶中,通入氮氣一段時間。移取10mL鹽酸于反應瓶中,水浴加熱,繼續(xù)通入氮氣。已知乙酸鋅與硫化氫反應生成硫化鋅沉淀(硫化氫被完全吸收)。
Ⅱ.滴定
關閉氣源,往兩個吸收管中各加入0.010mol·L-1的碘標準溶液100mL(過量),再加入鹽酸5mL,靜置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸鈉標準溶液對兩支吸收管中的液體進行滴定。(已知:![]() )
)
回答下列問題:
(1)水浴加熱的溫度不能高于85℃,原因是_____________________________。
(2)加入碘標準溶液時,吸收管中發(fā)生反應的化學方程式為________________。
(3)該實驗使用兩個吸收管的原因是_____________________________,若只使用一個吸收管,會導致測定結果偏______________________(填“高”或“低”)。
(4)該200mL水樣經(jīng)吹氣、固硫后,滴定操作時共消耗160mLNa2S2O3溶液,則廢水中硫的含量為________mg·L-1。
(5)實驗室常用FeS固體與酸反應制取H2S。實驗室制取H2S時,從反應物與生成物的狀態(tài)、性質和反應條件分析,下列發(fā)生裝置中可選用的是________(填序號)。

(6)將二氧化氯溶液加入硫化氫溶液中,然后加入少量稀鹽酸酸化的氯化鋇溶液,發(fā)現(xiàn)有白色沉淀生成。寫出二氧化氯與硫化氫溶液反應的離子方程式:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列說法正確的是
A. ①和②產物的陰陽離子個數(shù)比不相等
B. ①和②生成等物質的量的產物,轉移電子數(shù)不同
C. 常溫下Na與足量O2反應生成Na2O,隨溫度升高生成Na2O的速率逐漸加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以TiO2為催化劑的光熱化學循環(huán)分解CO2反應為溫室氣體減排提供了一個新途徑,該反應的機理及各分子化學鍵完全斷裂時的能量變化如下圖所示。
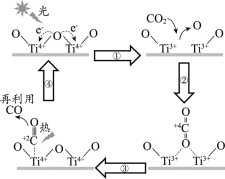
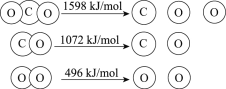
下列說法正確的是
A.過程①中鈦氧鍵斷裂會釋放能量
B.該反應中,光能和熱能轉化為化學能
C.使用TiO2作催化劑可以降低反應的焓變,從而提高化學反應速率
D.CO2分解反應的熱化學方程式為2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com