
從薄荷中提取的薄荷醇可制成醫藥。薄荷醇的結構簡式如下圖,下列說法正確的是
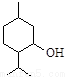
A.薄荷醇分子式為C10H20O,它是環己醇的同系物
B.薄荷醇的分子中至少有12個原子處于同一平面上
C.薄荷醇在Cu或Ag做催化劑、加熱條件下能被O2氧化為醛
D.在一定條件下,薄荷醇能發生取代反應、消去反應和聚合反應
科目:高中化學 來源:2017屆廣東省深圳市三校高三上學期第一次聯考化學卷(解析版) 題型:填空題
按要求完成下列空白:
⑴印刷電路板是由高分子材料和銅箔復合而成.刻制印刷電路時,要用FeCl3溶液作為“腐蝕液”,生成CuCl2和FeCl2.請寫出反應的離子方程式 。
⑵請寫出在堿性溶液中,ClO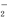 與Fe2+反應的離子方程式為: 。
與Fe2+反應的離子方程式為: 。
⑶NaAlH4是重要的還原劑。請寫出NaAlH4與水發生氧化還原反應的化學方程式: 。
⑷+6價鉻的化合物毒性較大,常用NaHSO3將酸性廢液中的Cr2O72-還原成Cr3+,請寫出該反應的離子方程式: 。
⑸亞氯酸鈉(NaClO2)溶液可作為煙氣的吸收劑,并對煙氣進行脫硫、脫硝。在裝有亞氯酸鈉溶液的鼓泡反應器中通入含有SO2和NO的煙氣,反應溫度為323 K,NaClO2溶液濃度為5×10?3mol·L?1。反應一段時間后溶液中離子濃度的分析結果如下表。
離 | SO | SO | NO | NO | Cl? |
c/(mol·L?1) | 8.35×10?4 | 6.87×10?6 | 1.5×10?4 | 1.2×10?5 | 3.4×10?3 |
寫出NaClO2溶液脫硝過程中主要反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省汕頭市高三上學期期末化學試卷(解析版) 題型:選擇題
下列有關物質的分離說法正確的是
A.檢查是否漏水是滴定管、容量瓶、分液漏斗等儀器使用的第一步操作
B.碘水中加CCl4振蕩靜置后,上層為紫色,下層幾乎為無色
C.可用加熱法分離NH4Cl(s)和I2(s)
D.蒸餾、分餾和干餾都是利用組分沸點不同而分離的方法
查看答案和解析>>
科目:高中化學 來源:2017屆廣東省清遠市清城區高三上期末B卷化學試卷(解析版) 題型:選擇題
化學平衡主要研究下列哪一類反應的規律( )
A.部分反應 B.任何反應 C.可逆反應 D.氣體反應
查看答案和解析>>
科目:高中化學 來源:2017屆四川省綿陽市高三1月診斷性考試化學試卷(解析版) 題型:填空題
合成氨工業涉及固體燃料的氣化,需要研究CO2與CO之間的轉化。為了弄清其規律,讓一定量的CO2與足量碳在體積可變的密閉容器中反應:C(s)+CO2(g) 2CO(g) ∆H,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:
2CO(g) ∆H,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:
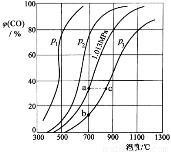
回答下列問題:
(1)p1、p2、p3的大小關系是______________,欲提高C與CO2反應中CO2的平衡轉化率,應采取的措施為 。圖中a、b、c三點對應的平衡常數大小關系是____________。
(2)900 ℃、1.013 MPa時,1 mol CO2與足量碳反應達平衡后容器的體積為V,CO2的轉化率為_________,該反應的平衡常數K= 。
(3)將(2)中平衡體系溫度降至640 ℃,壓強降至0.1013 MPa,重新達到平衡后CO2的體積分數為50%。條件改變時,正反應和逆反應速率如何變化?_______,二者之間有何關系?____________________。
(4)一定條件下,在CO2與足量碳反應所得平衡體系中加入H2和適當催化劑,有下列反應發生:CO(g)+3H2(g) CH4(g)+H2O(g) ∆H1=-206.2 kJ/mol
CH4(g)+H2O(g) ∆H1=-206.2 kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=-41.2 kJ/mol
CO2(g)+H2(g) ∆H2=-41.2 kJ/mol
① 則二氧化碳與氫氣反應轉化為甲烷和水蒸氣的熱化學方程式是_________________。
② 已知298 K時相關化學鍵鍵能數據為:
化學鍵 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
則根據鍵能計算,∆H1= ,它與上述實測值差異較大的原因可能是 。
查看答案和解析>>
科目:高中化學 來源:2017屆山東省濰坊市臨朐縣高三12月階段測化學試卷(解析版) 題型:填空題
硫及其化合物用途廣泛,研究硫及其化合物性質和用途意義重大。
⑴利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟。
已知:SO2(g)+1/2O2(g) SO3(g) △H=-98 kJ·mol-1。某溫度下該反應的平衡常數K=10/3。
SO3(g) △H=-98 kJ·mol-1。某溫度下該反應的平衡常數K=10/3。
①該溫度下,向100 L的恒容密閉容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),則反應開始時v(正) _________ v (逆)(填“<”、“>”或“=”)。
(逆)(填“<”、“>”或“=”)。
②該溫度下,向一體積為2 L的恒容密閉容器中充入2.0 mol SO2和1.0 molO2,反應一段時間后容器壓強為反應前的80%,此時SO2的轉化率為_______________。
③在②中的反應達到平衡后,改變下列條件,能使SO2(g)平衡濃度比原來減小的是__________(填字母)。
A.保持 溫度和容器體積不變,充入1.0 mol O2
溫度和容器體積不變,充入1.0 mol O2
B.升高溫度
C.保持溫度和容器體積不變,充入1.0  mol SO3
mol SO3
D.增大容器體積
⑵室溫下,Li /FeS2二次電池所用的電解質是非水液體電解質,放電行為與溫度有關。
①該電池電解質為非水液體電解質,原因是___________________。
②溫度低時,鋰與FeS2反應只生成A物質,產生第一次放電行為;溫度升高,鋰與A繼續反應(產生物之一為Fe),產生第二次放電行為。若二次行為均進行完全且放電量恰好相等,請寫出化學反應方程式:第一次放電:__________________;第二次放電:________________。
⑶制取高純度黃鐵礦的另一種方法是:以LiCl—KCl低共熔點混合物為電解質,FeS為陽極,Al為陰極,在適當的電壓下電解,寫出陽極方程式______________。
查看答案和解析>>
科目:高中化學 來源:2017屆山東省濰坊市臨朐縣高三12月階段測化學試卷(解析版) 題型:選擇題
含乙酸鈉和氯苯(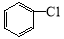 )的廢水可以利用微生物電池除去,其原理如圖所示,下列說法錯誤的是
)的廢水可以利用微生物電池除去,其原理如圖所示,下列說法錯誤的是
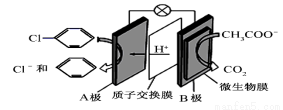
A.該裝置能將化學能轉化為電能
B.B極上發生氧化反應
 C. 每有1 mol CH3COO-被氧化,電路中通過8 mol電子
C. 每有1 mol CH3COO-被氧化,電路中通過8 mol電子
D.A極電極反應式為: +2e-+H+=Cl-+
+2e-+H+=Cl-+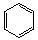
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省株洲市高三上教學質檢一化學試卷(解析版) 題型:選擇題
設NA阿伏伽德羅常數的值。己知反應
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1=a kJ/mol
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2=b kJ/mol,其它數據如表:
化學鍵 | C═O | O═O | C-H | O-H |
鍵能kJ·mol-1 | 798 | x | 413 | 463 |
下列說法正確的是
A.上表中 x=(1796+b)/2
B.H2O(g)═H2O(l) △S<0,△H═(a-b )kJ/mol
C.當有4NA個C-H鍵斷裂時,該反應放出熱量一定為a kJ
D.利用反應(1)設計的原電池電解精煉銅時,當負極輸出0.2NA個電子時,電解槽的陽極質量一定減輕6.4g
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省荊門市高三元月調考理綜化學試卷(解析版) 題型:填空題
(1)火箭的第一、二級發動機中,所用的燃料為偏二甲肼和四氧化二氮,偏二甲肼可用肼來制備。
①用肼(N2H4)作燃料,四氧化二氮作氧化劑,兩者反應生成氮氣和氣態水。
已知: N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
寫出氣態肼和N2O4反應生成氮氣和氣態水的熱化學方程式:________________________。
②已知四氧化二氮在大氣中或在較高溫度下很難穩定存在,它很容易轉化為二氧化氮。試推斷出二氧化氮制取四氧化二氮的反應條件(或措施): ____________________。
(2)在0.5L恒容密閉容器中,一定量的N2與H2進行反應:N2(g)+3H2(g) 2NH3(g) △H=bkJ•mol﹣1,其化學平衡常數K值和溫度的關系如下:
2NH3(g) △H=bkJ•mol﹣1,其化學平衡常數K值和溫度的關系如下:
溫度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
寫出該反應的化學平衡常數的表達式: ,b 0(填“大于”、“小于”或“等于”)
②400℃時,測得某時刻氨氣、氮氣、氫氣的物質的量分別為3mol、2mol、1mol時,此時刻該反應的v正(N2) v逆(N2)(填“大于”、“小于”或“等于”)
(3)科學家制造出一種使用固體電解質的燃料電池,其效率更高,可用于航空航天。如圖1所示裝置中,以稀土金屬材料作惰性電極,在兩極上分別通入CH4和空氣,其中固體電解質是摻雜了Y2O3的ZrO2固體,它在高溫下能傳導陽極生成的O2-離子(O2+4e-===2O2-)。

①c電極的名稱為________,d電極上的電極反應式為______________________。
②如圖2所示為用惰性電極電解100 mL 0.5 mol·L-1CuSO4溶液,a電極上的電極反應式為___________________。若a電極產生56 mL(標準狀況)氣體,則所得溶液的pH=__________(不考慮溶液體積變化) 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com