
 二氧化硒(SeO2)是一種氧化劑,其被還原后的單質硒可能成為環境污染物,通過與濃HNO3或H2SO4反應生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一種氧化劑,其被還原后的單質硒可能成為環境污染物,通過與濃HNO3或H2SO4反應生成SeO2以回收Se.完成下列填空:分析 (1)利用題中信息可知Se與濃HNO3反應,Se被氧化為+4價的H2SeO3,HNO3還原為NO與NO2,利用電子守恒和限定條件(生成NO與NO2的物質的量之比為1:1,即二者計量系數比為1:1)可得方程式,結合兩種還原產物分析;
(2)根據反應的方程式可知,SeO2~2I2~4Na2S2O3,根據n=cV計算消耗的n(Na2S2O3),根據關系式計算樣品中n(SeO2),再根據m=nM計算SeO2的質量,進而計算樣品中SeO2的質量分數;
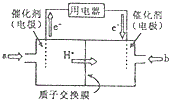
(3)①根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應;
②根據電解池的工作原理和電極方程式來計算.
解答 解:(1)利用題中信息可知Se與濃HNO3反應,Se被氧化為+4價的H2SeO3,HNO3還原為NO與NO2,生成NO與NO2的物質的量之比為1:1,即二者計量系數比為1:1,令二者系數為1,根據電子轉移守恒可知,Se的系數為$\frac{1×3+1×1}{4}$=1,故反應方程式為Se+2HNO3(濃)=H2SeO3+NO↑+NO2↑,如不對該反應還原產物的比例作限制,該反應可能出現多組配平系數,是因該反應有兩種還原產物,兩者的比例和還原劑的用量都可以發生改變;
故答案為:Se+2HNO3(濃)=H2SeO3+NO↑+NO2↑;可能;該反應有兩種還原產物,兩者的比例和還原劑的用量都可以發生改變;
(2)根據反應的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000 mol/L×0.025L=0.005mol,根據關系式計算樣品中n(SeO2)=0.005mol×$\frac{1}{4}$=0.00125mol,故SeO2的質量為0.00125mol×111g/mol=0.13875g,所以樣品中SeO2的質量分數為$\frac{0.13875g}{0.1600g}$×100%=86.6%,故答案為:86.6%;
(3)①根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應,負極反應式為 CH3OH-6e-+H2O=CO2+6H+,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+4H+=2H2O,
故答案為:負;CH3OH-6e-+H2O=CO2+6H+;
②用此電池以惰性電極電解飽和食鹽水的電極反應為:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH-,當兩極共收集到標準狀況下的氣體1.12L(0.05mol)時,則生成氫氧化鈉的物質的量是0.05mol,所以COH-=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以PH=13,故答案為:13.
點評 本題考查氧化還原反應及計算以及電化學的知識等,為高頻考點,把握守恒法為解答的關鍵,側重氧化還原反應配平及計算的考查,注意掌握基礎知識的掌握,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:多選題
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)=c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-) | |
| C. | pH=12的NaOH溶液與pH=12的氨水中:c(Na+)=c(NH4+) | |
| D. | pH=3的鹽酸和pH=11的氨水等體積混合后:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某同學設計了如圖所示裝置進行石油蒸餾的實驗,請回答下列有關問題:
某同學設計了如圖所示裝置進行石油蒸餾的實驗,請回答下列有關問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 | B. | 4.5 | C. | 5.5 | D. | 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①④⑥ | C. | ①②⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 44gCO2 的體積為22.4L | |
| B. | 標準狀況下,22.4L水中含有NA個水分子 | |
| C. | 常溫常壓下,28gN2中所含的原子數目為2NA | |
| D. | 如果11.2LN2中含有n個氮氣分子,則阿佛加德羅常數一定為2n |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 正極附近的SO42-濃度逐漸增大 | B. | 電子通過導線由銅片流向鋅片 | ||
| C. | 正極有O2逸出 | D. | 銅片上有H2逸出 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com