
【題目】NiSO4·xH2O是一種綠色易溶于水的晶體,廣泛用于鍍鎳、電池等,可由電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素)為原料獲得.操作步驟如圖:

(1)在待鍍件上鍍鎳時,待鍍件應作____極,電鍍過程中電解質溶液濃度___ (填“增大”、“減小”、“不變”)
(2)向濾液Ⅰ中加入FeS是為了除去Cu2+、Zn2+等雜質,則除去Cu2+的離子方程式為_____________.當Zn2+恰好沉淀完全時,在CuS、ZnS共存的混合液中c(Zn2+)=10﹣5mol/L,則c(Cu2+)=______mol/L(已知Ksp(CuS)=1.3×10﹣36,Ksp(ZnS)=1.6×10﹣24).
(3)對濾液Ⅱ中先加H2O2再調pH,調pH的目的是______________________________________________________________________.
(4)為測定NiSO4·xH2O晶體x的值,稱取26.3g晶體加熱至充全失去結晶水,剩余固體15.5g,則x的值等于__________________.
【答案】陰 不變 FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s) 8.1×10-18 mol·L-1 調節pH有利于Fe3+水解生成氫氧化鐵沉淀而除去 6
【解析】
電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素),加入稀硫酸過濾得到含有鎳離子、銅離子、鋅離子、亞鐵離子的濾液,后在濾液中加入FeS,生成CuS、ZnS,可除去Cu2+、Zn2+等雜質,對濾液Ⅱ先加W,應為過氧化氫,可氧化Fe2+生成Fe3+,有利于水解生成氫氧化鐵沉淀而除去,過濾后在濾液中加入碳酸鈉,可生成NiCO3,過濾后加入硫酸可生成NiSO4,經蒸發、濃縮、冷卻結晶可得到硫酸鎳晶體。
(1)在待鍍件上鍍鎳,待鍍件作陰極,鍍層金屬鎳做陽極,電解質溶液用鎳離子的鹽溶液,陰極析出的鎳與陽極溶解的鎳等量,故電解質溶液的濃度不變;
(2)向濾液Ⅰ中加入FeS主要目的是除去Cu、Zn等雜質,說明CuS的溶解度更小,反應的離子方程式為FeS(s)+Cu2+(aq)=Fe2+(aq)+CuS(s),
已知Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.6×10-24,當Zn2+恰好沉淀完全時,在CuS、ZnS共存的混合液中c(Zn2+)=10-5mol·L-1,則溶液中的c(S2-)=![]() =
=![]()
mol·L-1=1.6×10-19mol·L-1,則c(Cu2+)=![]() =
=![]() mol·L-1≈8.1×10-18 mol·L-1;
mol·L-1≈8.1×10-18 mol·L-1;
(3)對濾液Ⅱ先加過氧化氫,可氧化Fe2+生成Fe3+,調節pH有利于水解生成氫氧化鐵沉淀而除去;
(4)26.3g晶體加熱至完全失去結晶水,剩余固體15.5g,失去水的質量=26.3g-15.5g=10.8g,NiSO4的質量為15.5g,計算物質的量得到1:x=![]() ,解得x=6。
,解得x=6。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,![]() 和
和![]() 的電離常數分別為
的電離常數分別為![]() 和
和![]() 。將
。將![]() 和體積均相同的兩種酸溶液分別稀釋,其
和體積均相同的兩種酸溶液分別稀釋,其![]() 隨加水體積的變化如圖所示。下列敘述正確的是( )
隨加水體積的變化如圖所示。下列敘述正確的是( )

A. 曲線Ⅰ代表![]() 溶液
溶液
B. 溶液中水的電離程度:b點>c點
C. 從c點到d點,溶液中 保持不變(其中
保持不變(其中![]() 、
、![]() 分別代表相應的酸和酸根離子)
分別代表相應的酸和酸根離子)
D. 相同體積a點的兩溶液分別與![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4 molA氣體和2mol B氣體在2L的容器中混合,并在一定條件下發生如下反應:2A(g)+B(g)![]() 2C(g),若經2s后測得C的濃度為0.6mol·L-1,則
2C(g),若經2s后測得C的濃度為0.6mol·L-1,則
(1)用物質A表示的反應速率為____。
(2)用物質B表示的反應速率為____。
(3)2s時物質B的轉化率為_____。
(4)2s時物質A的濃度為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固定容積為2 L的密閉容器中發生反應xA(g)+yB(g) ![]() zC(g),圖1表示T ℃時容器中各物質的量隨時間變化的關系,圖2表示平衡常數K隨溫度變化的關系。結合圖像判斷,下列結論正確的是( )
zC(g),圖1表示T ℃時容器中各物質的量隨時間變化的關系,圖2表示平衡常數K隨溫度變化的關系。結合圖像判斷,下列結論正確的是( )
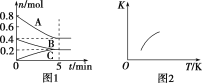
A.該反應可表示為2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.T ℃時該反應的平衡常數K=6.25
C.當容器中氣體密度不再變化時,該反應達到平衡狀態
D.T ℃,在第6 min時再向體系中充入0.4 mol C,再次達到平衡時C的體積分數大于0.25
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】20世紀50年代科學家提出價層電子對互斥模型(簡稱VSEPR模型),用于預測簡單分子立體結構。其要點可以概括為:
Ⅰ、用AXnEm表示只含一個中心原子的分子組成,A為中心原子,X為與中心原子相結合的原子,E為中心原子最外層未參與成鍵的電子對(稱為孤對電子),(n+m)稱為價層電子對數。分子中的價層電子對總是互相排斥,均勻的分布在中心原子周圍的空間;
Ⅱ、分子的立體構型是指分子中的原子在空間的排布,不包括中心原子未成鍵的孤對電子;
Ⅲ、分子中價層電子對之間的斥力主要順序為:i、孤對電子之間的斥力>孤對電子對
與共用電子對之間的斥力>共用電子對之間的斥力;ii、雙鍵與雙鍵之間的斥力>雙鍵與單鍵之間的斥力>單鍵與單鍵之間的斥力;iii、X原子得電子能力越弱,A-X形成的共用電子對之間的斥力越強。 請仔細閱讀上述材料,回答下列問題:
(1)指出下面物質分子或離子的空間構型:PO43-_____________________________; PCl5_____________________。
(2) 有兩種活性反應中間體微粒,它們的微粒中均含有1個碳原子和3個氫原子。請依據下面給出的這兩種微粒的球棍模型,寫出相應的化學式:
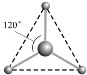 __________________;
__________________;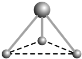 __________________。
__________________。
(3) 按要求寫出第二周期非金屬元素構成的中性分子的化學式:平面三角形分子___________,三角錐形分子___________,四面體形分子_____________。
(4) 下列一組微粒中鍵角由大到小順序排列為____________________(用編號填寫)
①HCN ②SiF4 ③SCl2 ④CO32- ⑤H3O+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮氧化物反應機理,對于控制汽車尾氣、保護環境有重要意義。
(1)NO在空氣中存在如下反應:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反應分兩步完成,其中第一步反應①如下,寫出第二步反應②的熱化學方程式(其反應的焓變ΔH2用含ΔH、ΔH1的式子來表示): ① 2NO(g)
2NO2(g) ΔH,上述反應分兩步完成,其中第一步反應①如下,寫出第二步反應②的熱化學方程式(其反應的焓變ΔH2用含ΔH、ΔH1的式子來表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化還原氮氧化物(SCR)技術是目前應用最廣泛的煙氣氮氧化物脫除技術。反應的熱化學方程式為: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反應在恒容密閉容器中進行,在其它相條件同時,選用不同的催化劑,反應產生N2的物質的量隨時間變化如圖所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反應在恒容密閉容器中進行,在其它相條件同時,選用不同的催化劑,反應產生N2的物質的量隨時間變化如圖所示。

①在催化劑A的作用下,經過相同時間,測得脫氮率隨反應溫度的變化情況如圖2所示,據圖可知,在相同的時間內,300℃之前,溫度升高脫氮率逐漸增大,300℃之后溫度升高脫氮率逐漸減小(催化劑均末失效),寫出300℃之后脫氮率減小的原因是_________。
②其他條件相同時,請在圖中補充在催化劑B作用下脫氮率隨溫度變化的曲線________。

(3)工業制HNO3的尾氣中含有的NO2和NO常用NaOH溶液吸收,反應的化學方程式為:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,現有平均組成為NOx的NO、NO2混合氣體,通入足量的NaOH溶液中,充分反應后沒有氣體剩余,則:
①x的取值范圍為_________________。
②反應后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代數式表示)
(4)電解法處理氮氧化合物是目前大氣污染治理的一個新思路,原理是將NOx在電解池中分解成無污染的N2和O2除去,如圖示,兩電極間是新型固體氧化物陶瓷,在一定條件下可自由傳導O2-,電解池陰極反應為___。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據報道,化合物M對番茄灰霉菌有較好的抑菌活性,其合成路線如下圖所示。
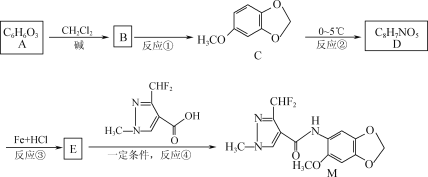
已知:
![]()
回答下列問題:
(1)化合物C中的含氧官能團為____________,反應④的反應類型為____________。
(2)寫出E的結構簡式:________________________。
(3)寫出反應②的化學方程式:_____________________________________________。
(4)寫出化合物C滿足下列條件的一種同分異構體的結構簡式:_________________。
① 含苯環結構,能在堿性條件下發生水解;
② 能與FeCl3發生顯色反應;
③ 分子中含有4種不同化學環境的氫。
(5)已知CH3CH2CN![]() CH3CH2COOH。請以
CH3CH2COOH。請以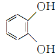 、CH2==CHCN和乙醇為原料合成化合物
、CH2==CHCN和乙醇為原料合成化合物 ![]() ,寫出制備的合成路線流程圖(無機試劑任用)_____。
,寫出制備的合成路線流程圖(無機試劑任用)_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某溫度下,某一密閉容器中,M、N、R三種氣體濃度的變化如圖a所示,若其它條件不變,當溫度分別為T1和T2時,N的體積分數與時間關系如圖b所示。則下列結論正確的是( )

A.該反應的熱化學方程式M(g)+3N(g)![]() 2R(g)△H>0
2R(g)△H>0
B.達到平衡后,若其他條件不變,減小容器體積,平衡向逆反應方向移動
C.達到平衡后,若其它條件不變,升高溫度,正、逆反應速度均增大,M的轉化率減小
D.達到平衡后,若其他條件不變,通入稀有氣體,平衡一定向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)寫出NaHSO4在熔融狀態下的電離方程式 _______。
(2)寫出NaHCO3在水溶液中的電離方程式 ________。
(3)1mol乙烷氣體(C2H6)在氧氣中完全燃燒生成二氧化碳和液態水,放出熱量1558.3 kJ,寫出乙烷燃燒熱的熱化學方程式________。
(4)含NaOH 20.0g的稀溶液與足量的稀鹽酸反應,放出28.7KJ的熱量,表示該反應的熱化學方程式是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com