
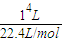 =
=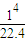 mol,結合熱化學方程式可知,4mol一氧化碳和氫氣完全燃燒放熱放熱1008KJ,所以
mol,結合熱化學方程式可知,4mol一氧化碳和氫氣完全燃燒放熱放熱1008KJ,所以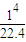 mol,混合氣體完全燃燒放出的熱量=
mol,混合氣體完全燃燒放出的熱量=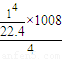 =1.125×105KJ;
=1.125×105KJ;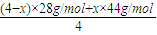 =40g/L計算得到x=3mol;
=40g/L計算得到x=3mol;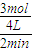 =0.375mol/L;
=0.375mol/L;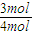 ×100%=75%
×100%=75%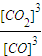 =
=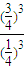 =27;
=27;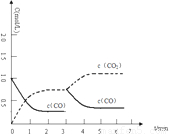
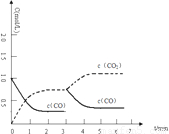


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
 (2009?南京二模)工業上可利用合成氣(CO和H2的混合氣體)生產甲醇(如反應④).已知:
(2009?南京二模)工業上可利用合成氣(CO和H2的混合氣體)生產甲醇(如反應④).已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 組別 | 原料氣中各組分的體積分數 | |||
| CO | CO2 | H2 | N2 | |
| 第1組 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2組 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3組 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4組 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5組 | 20.3 | 10.9 | 60.9 | 7.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、該反應的△S<0 | B、該反應在任何溫度下均能自發進行 | C、向容器中充入少量He,平衡向正反應方向移動 | D、升高溫度平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 反應條件 | 主要產物 | 生成1mol有機物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常壓 | 甲烷(和水蒸氣) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固態烷烴 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 異丁烷、異戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有機化合物 | |
| Rh原子簇配合物,高壓液相 | 乙二醇 (少量乙酸、乙醇) |

查看答案和解析>>
科目:高中化學 來源: 題型:
 )因柔韌性好而被用于制造汽車門窗密封膠條,工業生產乙丙橡膠的單體是
)因柔韌性好而被用于制造汽車門窗密封膠條,工業生產乙丙橡膠的單體是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com