
| t/s | 0 | 50 | 100 | 150 |
| c(X2O5)mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
| A. | T溫度下的平衡常數為K=64(mol/L)3,100s時轉化率為50% | |
| B. | 50s內X2O5分解速率為0.03 mol/(L•s) | |
| C. | T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若T1>T2,則K1>K2 | |
| D. | 若只將恒容改為恒壓,其它條件都不變,則平衡時X2O5的轉化率和平衡常數都不變 |
分析 A.由表中數據可知,100s時處于平衡狀態,平衡時c(X2O5)=2mol/L,則:
2X2O5(g)═4XO2(g)+O2(g)
起始濃度(mol/L):4 0 0
變化濃度(mol/L):2 4 1
平衡濃度(mol/L):2 4 1
根據K=$\frac{{c}^{4}(X{O}_{2})×c({O}_{2})}{{c}^{2}({X}_{2}{O}_{5})}$計算平衡常數,轉化率=$\frac{濃度變化量}{起始濃度}$×100%;
B.50s內X2O5濃度變化量為(4-2.5)mol/L=1.5mol/L,根據v=$\frac{△c}{△t}$計算50s內X2O5分解速率;
C.正反應為吸熱反應,升高溫度平衡正向移動,平衡常數增大;
D.恒容條件下,隨反應進行容器內壓強增大,若只將恒容改為恒壓,其它條件都不變,等效為在原平衡基礎上減小壓強,平衡正向移動,平衡時X2O5的轉化率增大,平衡常數只受溫度影響,溫度不變,平衡常數不變.
解答 解:A.由表中數據可知,100s時處于平衡狀態,平衡時c(X2O5)=2mol/L,則:
2X2O5(g)═4XO2(g)+O2(g)
起始濃度(mol/L):4 0 0
變化濃度(mol/L):2 4 1
平衡濃度(mol/L):2 4 1
T溫度下平衡常數K=$\frac{{c}^{4}(X{O}_{2})×c({O}_{2})}{{c}^{2}({X}_{2}{O}_{5})}$=$\frac{(4mol/L)^{4}×1mol/L}{(2mol/L)^{2}}$=64(mol/L)3,100s時轉化率為$\frac{2mol/L}{4mol/L}$×100%=50%,故A正確;
B.50s內X2O5濃度變化量為(4-2.5)mol/L=1.5mol/L,50s內X2O5分解速率=$\frac{1.5mol/L}{50s}$=0.03mol/(L.s),故B正確;
C.T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若溫度T1>T2,正反應為吸熱反應,升高溫度平衡正向移動,平衡常數增大,則K1>K2,故C正確;
D.恒容條件下,隨反應進行容器內壓強增大,若只將恒容改為恒壓,其它條件都不變,等效為在原平衡基礎上減小壓強,平衡正向移動,平衡時X2O5的轉化率增大,平衡常數只受溫度影響,溫度不變,平衡常數不變,故D錯誤,
故選:D.
點評 本題考查化學平衡計算與影響因素、平衡常數等,難度中等,注意平衡常數及單位與方程式中化學計量數有關,對同一反應,平衡常數只受溫度影響,溫度不變,平衡常數不變.


科目:高中化學 來源: 題型:選擇題
| 物質 | 雜質(少量) | 試劑和操作方法 | |
| A | O2 | H2O(蒸汽) | 通過濃H2SO4 |
| B | CO2 | CO | 點燃 |
| C | KCl固體 | KClO3 | 加入MnO2并加熱 |
| D | KNO3溶液 | Ba(NO3)2溶液 | 加入適量的Na2SO4溶液,過濾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A的平均消耗速率為0.32mol•L-1•min-1 | |
| B. | B的轉化率為80% | |
| C. | x的值為2 | |
| D. | B的平衡濃度為1mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水總是自發地由高處往低處流 | |
| B. | 有序排列的火柴散落時成為無序排列 | |
| C. | 放熱反應容易進行,吸熱反應不能自發進行 | |
| D. | 多次洗牌以后,撲克牌的毫無規律的混亂排列的幾大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 CuO可用作顏料、玻璃磨光劑、有機合成催化劑等.以下是用銅粉氧化法生產CuO的流程圖:
CuO可用作顏料、玻璃磨光劑、有機合成催化劑等.以下是用銅粉氧化法生產CuO的流程圖:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ?
?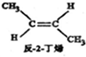 ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比順-2-丁烯穩定 | |
| B. | 順-2-丁烯的燃燒熱數值比反-2-丁烯小 | |
| C. | 減壓和升溫有利于平衡向生成正丁烷反應方向移動 | |
| D. | 反-2-丁烯氫化的熱化學方程式為: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com