
【題目】在一定條件下,Na2CO3溶液存在水解平衡:CO32﹣+H2OHCO3﹣+OH﹣ . 下列說法正確的是( )
A.稀釋溶液,水解平衡常數增大
B.通入CO2 , 平衡朝正反應方向移動
C.升高溫度, ![]() 減小
減小
D.加入NaOH固體,溶液pH減小
【答案】B
【解析】解:A、平衡常數僅與溫度有關,溫度不變,則稀釋時平衡常數是不變的,故A錯誤;B、CO2通入水中,生成H2CO3 , 可以與OH﹣反應,平衡正向移動,故B正確;
C、因水解是吸熱的,則升溫可以促進水解,平衡正向移動, ![]() 是增大的,故C錯誤;
是增大的,故C錯誤;
D、加入NaOH固體,堿性肯定增強,pH增大,故D錯誤;
故選:B.
【考點精析】解答此題的關鍵在于理解化學平衡常數的含義的相關知識,掌握指在一定條件下的可逆反應里,正反應和逆反應的速率相等,反應混合物中各組分的濃度不變的狀態,以及對化學平衡移動原理以及影響因素的理解,了解影響因素:①濃度:增大反應物(或減小生成物)濃度,平衡向正反應方向移動;②壓強:增大壓強平衡向氣體體積減小的方向移動.減小壓強平衡向氣體體積增大的方向移動;③溫度:升高溫度,平衡向吸熱反應方向移動.降低溫度,平衡向放熱反應方向移動;④催化劑:不能影響平衡移動.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】高溫下,某反應達平衡,平衡常數 ![]() .恒容時,溫度升高,H2濃度減小.下列說法正確的是( )
.恒容時,溫度升高,H2濃度減小.下列說法正確的是( )
A.該反應的焓變為正值
B.恒溫恒容下,增大壓強,H2濃度一定減小
C.升高溫度,逆反應速率減小
D.該反應的化學方程式為CO+H2OCO2+H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鹽在水溶液中有四種含鐵型體,25 ℃時,它們的物質的量分數隨pH 的變化如圖所示,下列敘述錯誤的是
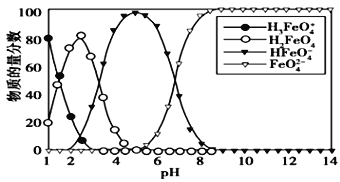
A. 向pH=5 的高鐵酸鹽溶液中加入KOH溶液,離子方程式為HFeO4-+OH-=FeO42-+H2O
B. 為獲得盡可能純凈的高鐵酸鹽,應控制pH≥9
C. 已知H3FeO4+的電離平衡常數分別為:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,當pH= 4時,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 時,溶液中主要含鐵型體濃度的大小關系為 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.工業上可由氫氣、氮氣合成氨氣,溶于水形成氨水。鹽酸和氨水是實驗室常見的電解質溶液。一定溫度下,向2L 密閉容器中加入N2(g)和H2(g),發生反應:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物質的量隨時間的變化如右圖所示。
2NH3(g)+ Q(Q>0), NH3物質的量隨時間的變化如右圖所示。

(1)0~2 min 內的平均反應速率 v(H2)=___________。
(2)該溫度下,反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常數表達式K=______。其平衡常數K與溫度T的關系如下表:
2NH3(g)+ Q(Q>0)的平衡常數表達式K=______。其平衡常數K與溫度T的關系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常數 K | 4×106 | K1 | K2 |
試判斷K1________K2(填寫“>”“=”或“<”)。
(3)下列能說明合成氨反應已達到平衡狀態的是______(填字母)(反應是在固定體積的密閉容器中進行的)
a.3v(N2) = v(H2)
b.容器內壓強保持不變
c.混合氣體的密度保持不變
d.25℃時,測得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常溫下,某同學將鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH 如下表。
實驗編號 | 氨水濃度/mol·L-1 | 鹽酸濃度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
請回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各離子濃度大小關系為_____________。
(5)請你再設計一個能證明一水合氨是弱電解質的方案。_____________。
【答案】 0.375 mol/(L·min) [NH3]2/[N2][H2]3 > bd < > [Cl-]= [NH4+]> [H+]= [OH-] 測量 0.1mol/L 氨水的 pH,pH小于13 等
【解析】試題分析:I.(1)根據![]() 計算反應速率;(2)根據平衡常數的定義書寫平衡常數表達式;反應 N2(g)+3H2(g)
計算反應速率;(2)根據平衡常數的定義書寫平衡常數表達式;反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動;(3)根據平衡狀態的特征分析;II. (4)①等濃度、等體積的鹽酸和氨水混合,恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸;根據電荷守恒分析離子濃度關系;(5)根據弱電解質部分電離或弱堿陽離子能水解設計方案;
2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動;(3)根據平衡狀態的特征分析;II. (4)①等濃度、等體積的鹽酸和氨水混合,恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸;根據電荷守恒分析離子濃度關系;(5)根據弱電解質部分電離或弱堿陽離子能水解設計方案;
解析:I.(1)2min內生成1mol氨氣,則消耗氫氣1.5mol, ![]() =
=![]() 0.375 mol/(L·min);(2)根據平衡常數的定義,平衡常數K=
0.375 mol/(L·min);(2)根據平衡常數的定義,平衡常數K=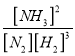 ;反應 N2(g)+3H2(g)
;反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動,平衡常數減小,所以K1>K2;(3)a.任意時刻速率比都等于系數比,所以3v(N2) = v(H2)不一定平衡,故a錯誤; b.N2(g)+3H2(g)
2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動,平衡常數減小,所以K1>K2;(3)a.任意時刻速率比都等于系數比,所以3v(N2) = v(H2)不一定平衡,故a錯誤; b.N2(g)+3H2(g)![]() 2NH3(g),氣體物質的量是變量,所以壓強是變量,容器內壓強保持不變一定達到平衡狀態,故b正確;c.根據
2NH3(g),氣體物質的量是變量,所以壓強是變量,容器內壓強保持不變一定達到平衡狀態,故b正確;c.根據![]() ,氣體密度是恒量, 混合氣體的密度保持不變不一定平衡,故c錯誤;d.25℃時K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,
,氣體密度是恒量, 混合氣體的密度保持不變不一定平衡,故c錯誤;d.25℃時K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,  ,Q=K,反應一定達到平衡狀態,故d正確。
,Q=K,反應一定達到平衡狀態,故d正確。
II. (4)①等濃度、等體積的鹽酸和氨水混合,恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解![]() ,所以溶液呈酸性pH<7;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸,所以c>0.2;根據電荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以離子濃度關系為[Cl-]= [NH4+]> [H+]= [OH-];(5)測量 0.1mol/L 氨水的 pH,pH小于13 ,能證明一水合氨部分電離是弱電解質;
,所以溶液呈酸性pH<7;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸,所以c>0.2;根據電荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以離子濃度關系為[Cl-]= [NH4+]> [H+]= [OH-];(5)測量 0.1mol/L 氨水的 pH,pH小于13 ,能證明一水合氨部分電離是弱電解質;
點睛:同濃度、同體積的一元強酸與一元弱堿混合,溶液呈酸性;同濃度、同體積的一元弱酸與一元強堿混合,溶液呈堿性;同濃度、同體積的一元強酸與一元強堿混合,溶液呈中性。
【題型】綜合題
【結束】
23
【題目】為了探究鐵、銅及其化合物的性質,某同學設計并進行了下列兩組實驗。
實驗一:

已知:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虛線框處宜選擇的裝置是________(填“甲”或“乙”);實驗時應先將螺旋狀銅絲加熱,變黑后再趁熱迅速伸入所制得的純凈氫氣中,觀察到的實驗現象是______________________。
(2)實驗后,為檢驗硬質玻璃管中的固體是否含+3價的鐵元素,該同學取一定量的固體并用一定濃度的鹽酸溶解,滴加_______溶液(填試劑名稱或化學式),沒有出現血紅色,說明該固體中沒有+3價的鐵元素。請你判斷該同學的結論是否正確并說明理由_________________。
實驗二:
綠礬是含有一定量結晶水的硫酸亞鐵,為測定綠礬中結晶水含量,將石英玻璃管(帶兩端開關K1和K2(設為裝置A)稱重,記為m1 g。將樣品裝入石英玻璃管中,再次將裝置A 稱重,記為m2 g,B為干燥管。按下圖連接好裝置進行實驗。

實驗步驟如下:(1)________,(2)點燃酒精燈,加熱,(3)______,(4)______,(5)______,
(6)稱量A, 重復上述操作步驟,直至 A 恒重,記為m3 g。
(3)請將下列實驗步驟的編號填寫在對應步驟的橫線上
a.關閉 K1 和 K2 b.熄滅酒精燈 c.打開 K1 和 K2 緩緩通入 N2 d.冷卻至室溫
(4)必須要進行恒重操作的原因是_________________。
(5)已知在上述實驗條件下,綠礬受熱只是失去結晶水,硫酸亞鐵本身不會分解, 根據實驗記錄,
計算綠礬化學式中結晶水數目 x=__________________(用含 m1、 m2、 m3的列式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不是Fe(OH)3膠體和MgCl2溶液共同具備的性質是( )
A. 都比較穩定,密封靜置不產生沉淀
B. 分散質微粒均可透過濾紙
C. 加入少量NaOH溶液都可以產生沉淀
D. 都有丁達爾效應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學在復習元素化合物的性質時,做了如下學習筆記,請你一起完成。
(1)氯氣的顏色為__________;由氯的原子結構示意圖推測,氯氣具有很強的______ 性。為了證明推測是否正確,進行如下實驗:
I:將紅熱的鐵絲伸入盛滿氯氣的集氣瓶,觀察鐵絲在氯氣中燃燒,有大量棕黃色煙。該反應的化學方程式是___________。
II:在空氣中點燃H2,然后將導管緩緩伸入盛滿氯氣的集氣瓶,可觀察到H2在氯氣中安靜燃燒,產生______色的火焰,瓶口有白霧的現象。
由實驗I、II可知,上述推測_____(填“正確”或“不正確”);理由是_____。
III:將氯氣溶于水,制得氯水。下列物質不能與新制氯水反應的是_____。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
(2)下列是一些常見物質之間的轉化關系。A是一種紅色金屬,F為不溶于酸的白色沉淀,B和C是兩種強酸。(圖中部分產物及反應條件略去)
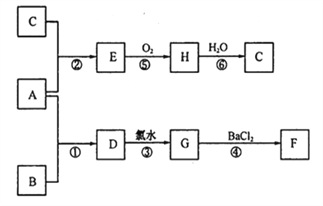
則:①A和B 分別為:A_________ B_________;
②A與B發生反應的條件是__________________;
③反應⑥的化學方程式為_____________________;
④上述反應中,不屬于氧化還原反應的是_______________。(填數字序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硫酸鹽是一種常見的食品添加劑,用如圖實驗可檢驗某食品中亞硫酸鹽含量(含量通常以1kg樣品中含SO2的質量計;所加試劑均足量)。下列說法不正確的是
![]()
A. 葡萄酒釀造時通入SO2起到了殺菌和增酸的作用
B. 反應①中若不通入N2則測得的SO2含量偏低
C. 反應①中煮沸的目的是加快亞硫酸的分解,降低SO2的溶解度
D. 若僅將②中的氧化劑“H2O2溶液”替換為“溴水”,對測定結果無影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質與其用途相符合的是
①Cl2——做消毒劑 ②AgBr——制膠卷,感光紙 ③AgI——人工降雨
④加碘食鹽——預防甲狀腺腫大 ⑤淀粉——檢驗I2的存在 ⑥NaClO——漂白紡織物
A.②③④⑤⑥B.①②③④⑤C.②③④⑤D.全部
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com