
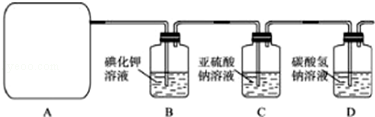

分析 Ⅰ.二氧化錳和濃鹽酸反應制取氯氣、氯化錳和水;
Ⅱ.(1)根據所給Cl2的生成反應的反應物狀態和反應是否需要加熱選擇氣體發生裝置;
(2)Na2SO3氧化的產物為Na2SO4,確定存在SO42-即可證明Na2SO3已部分被氧化.檢驗時,應取C中溶液少許于潔凈試管中,先加稀HCl至不再產生氣體以排除SO32-的干擾,然后再加入BaCl2溶液,若產生白色沉淀,則證明Na2SO3已部分被氧化;
(3)進入D的Cl2與水反應的離子方程式為Cl2+H2O?H++Cl-+HClO,HCl能與NaHCO3反應,離子方程式為H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能與NaHCO3反應;
(4)NaHCO3吸收Cl2的能力有限,應將尾氣通入NaOH溶液中;
(5)依據關系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,計算次氯酸鈣的質量進而計算次氯酸鈣的質量分數.
解答 解:Ⅰ.二氧化錳和濃鹽酸反應制取氯氣、氯化錳和水,反應的方程式為MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案為:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
Ⅱ.(1)依據方程式MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,反應物質為液體與固體,反應條件為加熱,應選屬于“固+液$\frac{\underline{\;\;△\;\;}}{\;}$氣”型的b;
故答案為:b;
(2)Na2SO3氧化的產物為Na2SO4,確定存在SO42-即可證明Na2SO3已部分被氧化.檢驗時,應取C中溶液少許于潔凈試管中,先加稀HCl至不再產生氣體以排除SO32-的干擾,然后再加入BaCl2溶液,若產生白色沉淀,則證明Na2SO3已部分被氧化;
故答案為:取少量溶液置于潔凈的試管中,向其中滴加稀鹽酸至不再產生氣體,再向其中滴入氯化鋇溶液,若產生白色沉淀,證明亞硫酸鈉被氧化;
(3)進入D的Cl2與水反應的離子方程式為Cl2+H2O?H++Cl-+HClO,HCl能與NaHCO3反應,離子方程式為H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能與NaHCO3反應;
故答案為:Cl2+H2O?H++Cl-+HClO;H++HCO3-=CO2↑+H2O;
(4)NaHCO3吸收Cl2的能力有限,應將尾氣通入NaOH溶液中;
故答案為:應將尾氣通入NaOH溶液中;
(5)依據題干給出方程式可得:Ca(ClO)2~2Cl2~2I2~4Na2S2O3,n[Ca(ClO)2]=$\frac{1}{4}$n(Na2S2O3)=20.0 mL×10-3 L•mL-1×0.1 mol•L-1×$\frac{250mL}{25mL}$×$\frac{1}{4}$=0.005 mol,Ca(ClO)2%=$\frac{0.005mol×143g/mol}{2.0g}$×100%=35.75%;
故答案為:35.75%;
點評 本題考查了氯氣的實驗室制備方法和性質的檢驗、有關方程式的計算,明確制備原理及性質是解題關鍵,題(5)注意把握各物質之間量的關系,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 硫酸銅溶于水呈酸性,可用來做殺菌劑 | |
| B. | 氨氣具有還原性,可用于檢查HCl泄漏 | |
| C. | MgO、Al2O3熔點高,可用于制作耐高溫坩堝 | |
| D. | FeCl3溶液顯酸性,可用于蝕刻印刷電路板 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2L 0.5mol•L-1硫酸鉀溶液中陰離子所帶電荷數為NA | |
| B. | 室溫下,1L pH=13的NaOH溶液中,由水電離的OH-數目為0.1NA | |
| C. | 氫氧燃料電池正極消耗22.4L(標準狀況)氣體時,電路中通過的電子數目為2NA | |
| D. | 0.1mol 對苯二甲酸中含有雙鍵的數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用氨水吸收少量二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | NH4HCO3溶液與過量NaOH溶液反應:NH4++OH-═NH3↑+H2O | |
| C. | 過量的鐵粉與濃硝酸反應:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| D. | 向漂白粉溶液中通入適量SO2:Ca2++2C1O-+SO2+H2O═CaSO3↓+2HC1O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲基橙呈黃色的溶液中:I-、Cl-、NO3-、Na+ | |
| B. | 含大量Al3+的溶液中:K+、Na+、NO3-、HCO3- | |
| C. | 常溫下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:CO32-、Cl-、F-、K+ | |
| D. | 由水電離出的c(OH-)=1×10-13 mol•L-1的無色溶液中:NO3-、Ba2+、K+、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 第一次 | 第二次 | 第三次 | |
| 體積(mL) | 16.10mL | 16.60mL | 15.90mL |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com