
分析 依據向容積為2L的密閉容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合氣體,依據平衡常數的計算方法計算出濃度商,然后根據計算結果與化學平衡常數比較來判斷是否達到平衡狀態,若平衡后從體系中移走SO3,是減少生成物的濃度,根據化學平衡移動原理可知平衡正向進行.
解答 解:2L的密閉容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合氣體,各氣體的濃度為:c(SO2)=$\frac{0.4mol}{2L}$=0.2mol/L、c(O2)=$\frac{0.18mol}{2L}$=0.09mol/L、c(SO3)=$\frac{1.2mol}{2L}$=0.6mol/L,此時的濃度商為:Qc=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{(0.6mol/L)^{2}}{(0.2mol/L)^{2}×0.09mol/L}$=100<K=600,反應正向移動,說明該反應沒有達到平衡狀態;若平衡后從體系中移走SO3,減少生成物的濃度,則平衡向著正反應向移動,
故答案為:否,正反應.
點評 本題考查化學平衡常數分析應用、反應進行方向判斷的方法等知識,化學平衡移動原理的理解應用,平衡常數和濃度商的計算比較是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:解答題
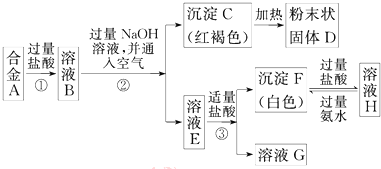
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
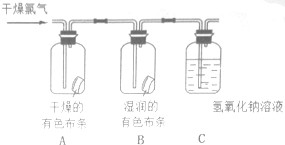 為了驗證氯氣的有關行政,某同學設計了如下的實驗.
為了驗證氯氣的有關行政,某同學設計了如下的實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
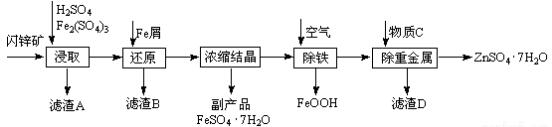
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
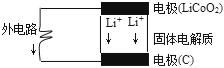 鋰電池的構造如圖所示,電池內部“→”表示放電時Li*的遷移方向,電池總反應可表示為:Li1-xCoO2+LixC$?_{放電}^{充電}$LiCoO2+6C,下列說法錯誤的是( )
鋰電池的構造如圖所示,電池內部“→”表示放電時Li*的遷移方向,電池總反應可表示為:Li1-xCoO2+LixC$?_{放電}^{充電}$LiCoO2+6C,下列說法錯誤的是( )| A. | 該電池的負極為LiCoO2 | |
| B. | 電池中的固體電解質可以是熔融的氯化鈉、干冰等 | |
| C. | 充電時的陰極反應:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外電路上的“→”表示放電時的電子流向 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
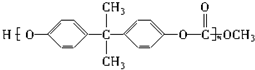 中含有
中含有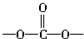 結構.
結構.| A. | ②⑤ | B. | ②④⑥ | C. | ①②③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 鈉 | Na2CO3 | 金剛石 | 石墨 | |
| 熔點(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸點(℃) | 882.9 | 1850(分解產生CO2) | ---- | 4250 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com