
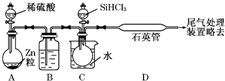
 晶體硅是一種重要的非金屬材料,制備純硅的主要步驟如下:
晶體硅是一種重要的非金屬材料,制備純硅的主要步驟如下:分析 (1)高溫下,碳和二氧化硅反應生成硅和一氧化碳;
(2)根據題中數據,采用分餾方法提純SiHCl3;
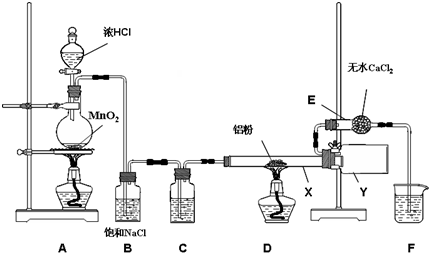
(3)稀硫酸與鋅反應生成氫氣,在B中用濃硫酸干燥,C中加入條件下SiHCl3與過量H2反應制備純硅,
①生成的氫氣含有水蒸氣,用濃H2SO4干燥;加熱促使SiHCl3氣化;
②SiHCl3和氫氣反應有硅單質生成,根據硅的顏色判斷D裝置中的顏色變化;反應溫度較高,普通玻璃會軟化;SiHCl3和H2反應生成硅和氯化氫;
③氫氣是可燃性氣體,易產生爆炸,為防止安全事故的發生,所以先通一段時間H2,將裝置中的空氣排盡;
④取少量產品于試管中加鹽酸溶解,再滴加氯水和KSCN(aq),若出現紅色說明含Fe,若不出現紅色說明不含Fe.
解答 解:(1)高溫下,碳和二氧化硅反應生成硅和一氧化碳,反應方程式為:SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO↑,
故答案為:SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO↑;
(2)SiHCl3(沸點33.0℃)中含有少量SiCl4(沸點57.6℃)和HCl(沸點-84.7℃),由于沸點差別較大,可以通過分餾除去雜質,
故答案為:分餾;
(3)①鋅和稀硫酸的反應是放熱反應,所以生成的氫氣含有水蒸氣,為干燥氫氣,一般選用濃H2SO4干燥;氣體的反應速率較大,所以加熱的目的是使SiHCl3氣化,
故答案為:濃硫酸;使滴入燒瓶中的SiHCl3氣化;
②高溫下,SiHCl3和氫氣反應生成硅單質,硅單質是灰黑色固體,所以D裝置中的現象是:石英管的內壁附有灰黑色晶體;由于高溫下,普通玻璃會軟化,所以使用石英玻璃;反應方程式為:SiHCl3+H2$\frac{\underline{\;高溫\;}}{\;}$Si+3HCl,
故答案為:石英管的內壁附有灰黑色晶體;高溫下,普通玻璃會軟化;SiHCl3+H2$\frac{\underline{\;高溫\;}}{\;}$Si+3HCl;
③氫氣是可燃性氣體,當氫氣的量達到一定時易產生爆炸,為防止安全事故的發生,所以先通一段時間H2,將裝置中的空氣排盡,
故答案為:先通一段時間H2,將裝置中的空氣排盡;
④鐵能和酸反應生成亞鐵離子,亞鐵離子有還原性,亞鐵離子能被氯水氧化生成鐵離子,鐵離子遇硫氰化鉀溶液變紅色,所以可以用氯水和硫氰化鉀溶液檢驗鐵的存在,
故選bd.
點評 本題考查了實驗方案設計的有關知識,為高考常見題型,鐵離子和亞鐵離子的檢驗在高考題中出現,這種類型的題是高考的熱點,是學習的重點,會根據實驗目的和物質的性質選取實驗裝置和實驗藥品,然后進行相應的實驗.


科目:高中化學 來源: 題型:多選題
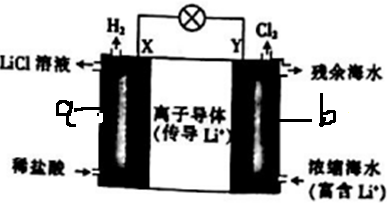
| A. | 電池工作時,Li+通過離子導體移向b區 | |
| B. | 電流由X極通過電路移向Y極 | |
| C. | 正極發生的反應為2H++2e-═H2↑ | |
| D. | Y極每生成1molCl2,a區得到2molLiCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,砷屬于p區元素.
,砷屬于p區元素.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 2AlCl3
2AlCl3查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{48}^{112}$Cd原子的中子數為64 | |
| B. | 聚氯化鋁能降污是因為它有強氧化性 | |
| C. | 聚氯化鋁是混合物 | |
| D. | 鎘的單質有導電性和延展性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com