
 常溫下,將Cl2緩慢通入水中至飽和,然后向其中滴加0.1mol/LNaOH溶液.整個實驗過程中溶液的pH變化曲線如圖所示,不考慮次氯酸分解,下列敘述正確的是( )
常溫下,將Cl2緩慢通入水中至飽和,然后向其中滴加0.1mol/LNaOH溶液.整個實驗過程中溶液的pH變化曲線如圖所示,不考慮次氯酸分解,下列敘述正確的是( )| A. | 實驗過程中用pH試紙測定溶液的pH | |
| B. | a~b段,溶液中 $\frac{c({H}^{+})}{c(O{H}^{-})}$ 減小 | |
| C. | b點對應溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c點對應溶液中:c(Na+)=c(Cl-)+c(ClO-) |
分析 A.氯氣與水反應生成次氯酸,次氯酸具有漂白性;
B.氯氣與水反應生成氯化氫和次氯酸,氯化氫完全電離生成氫離子,溶液酸性增強;
C.氯氣與水反應生成等物質的量的氯化氫和次氯酸,氯化氫為強電解質,次氯酸為弱電解質;
D.依據溶液中電荷守恒解答;
解答 解:A、氯氣和氫氧化鈉反應生成氯化鈉和次氯酸鈉,次氯酸鈉有強氧化性,能漂白,所以不能測其pH值,故A錯誤;
B、氯氣與水反應生成氯化氫和次氯酸,氯化氫完全電離生成氫離子,所以從a到b溶液酸性增強,溶液的pH逐漸變小,說明氫離子和氫氧根離子濃度比值變小,故B錯誤;
C、b點是氯水的飽和溶液,由于氯化氫和次氯酸都電離產生氫離子,所有氫離子濃度比氯離子濃度大,故C錯誤;
D、根據電荷守恒,在c點溶液為中性,氫離子濃度等于氫氧根離子濃度,則c(Na+)=c(Cl-)+c(ClO-),故D正確;
故選:D.
點評 本題考查了氯水性質,熟悉氯水成分,明確微粒具有性質是解題關鍵,注意電荷守恒在判斷離子濃度大小的應用,題目難度不大.


科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為了保持臘肉肉質鮮美,添加過量的亞硝酸鈉 | |
| B. | 為了防止食用魷魚變質,用甲醛水溶液浸泡存放 | |
| C. | 為了防止黃曲霉素對人體的危害,絕對不能食用霉變食物 | |
| D. | 為了防止攝入鋅不足引起疾病,過量服用補鋅藥劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
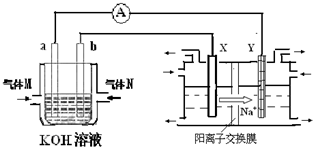
| 時間(h) 物質的量/(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
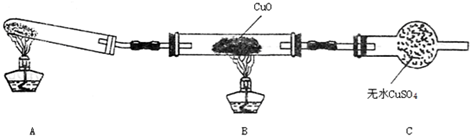
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
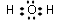 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
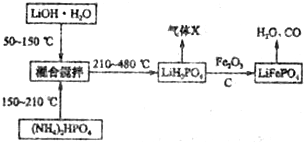
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com