
| 陽離子 | K+ Na+ Cu2+ Al3+ |
| 陰離子 | SO42- HCO3-NO3- OH- |
分析 ①將它們溶于水后,D為藍色溶液,其他均為無色溶液,則D中含有Cu2+離子;
②將E溶液滴入到C溶液中,出現白色沉淀,繼續滴加沉淀溶解,則C中含有Al3+離子,E中含有OH-離子;
③進行焰色反應實驗,只有B、C為紫色,則B、C含有K+離子,結合離子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入過量稀硝酸,A中放出無色氣體,則A中含有HCO3-離子,C、D中產生白色沉淀,則C、D中含有SO42-離子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤將B、D兩溶液混合,未見沉淀或氣體生成,則B是KNO3.
解答 解:①將它們溶于水后,D為藍色溶液,其他均為無色溶液,則D中含有Cu2+離子;
②將E溶液滴入到C溶液中,出現白色沉淀,繼續滴加沉淀溶解,則C中含有Al3+離子,E中含有OH-離子;
③進行焰色反應實驗,只有B、C為紫色,則B、C含有K+離子,結合離子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入過量稀硝酸,A中放出無色氣體,則A中含有HCO3-離子,C、D中產生白色沉淀,則C、D中含有SO42-離子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤將B、D兩溶液混合,未見沉淀或氣體生成,則B是KNO3.
(1)由上述分析可知,B為KNO3,D為CuSO4,
故答案為:KNO3;CuSO4;
(2)在A是NaHCO3溶液中加入少量澄清石灰水,發生反應生成碳酸鈣沉淀,觀察到的現象為產生白色沉淀,
故答案為:產生白色沉淀;
(3)A是NaHCO3,E是NaOH,1mol A的溶液與含1mol E的溶液反應生成碳酸鈉和水,蒸干過程中碳酸鈉水解得到碳酸氫鈉與氫氧化鈉,最終二者又反應得到Na2CO3,反應的離子方程式為:HCO3-+OH-=H2O+CO32-,
故答案為:Na2CO3 ,HCO3-+OH-=H2O+CO32-;
(4)C中含有鋁離子,鋁離子易水解生成氫氧化鋁膠體,膠體具有吸附性,能吸附水 中的懸浮物而凈水,水解反應方程式為:Al3++3H2O?Al(OH)3(膠體)+3H+,
故答案為:Al3++3H2O=Al(OH)3(膠體)+3H+.
點評 本題考查無機物推斷,屬于未知物的檢驗推斷,涉及離子共存、離子反應等,關鍵明確離子之間發生的反應現象,有利于培養學生的邏輯思維推理能力和,難度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:選擇題
 的有機物,下列關于它的說法不正確的是( )
的有機物,下列關于它的說法不正確的是( )| A. | 分子式為C10H16 | B. | 其一氯代物有8種 | ||
| C. | 能與溴水發生加成反應 | D. | 難溶于水,且密度比水大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其空間構型是直線形,由此可知它是非極性(填“極性”或“非極性”)分子.
,其空間構型是直線形,由此可知它是非極性(填“極性”或“非極性”)分子.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
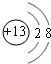 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族
| 選項 | a | b | c | d |
| X | 溫度 | 加入氫氣 | 加入丙 | 溫度 |
| Y | n(丙) | 丙的轉化率 | n(生成物) | n(H2) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若純堿中混有K2CO3,鹽酸用量將偏大;氣體產量將偏大 | |
| B. | 若純堿中混有NaHCO3,鹽酸用量將偏大;氣體產量將偏大 | |
| C. | 若純堿中混有KHCO3,鹽酸用量將偏小;氣體產量將偏大 | |
| D. | 若純堿中混有Na2SO3,鹽酸用量將偏大;氣體產量將偏小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com