
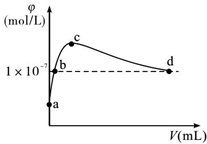
 常溫下,將CO2通入2LpH=12的KOH溶液中.溶液中水電離出的OH-離子濃度(φ)與通入的CO2的體積(V)的關系如圖所示.下列敘述不正確的是( )
常溫下,將CO2通入2LpH=12的KOH溶液中.溶液中水電離出的OH-離子濃度(φ)與通入的CO2的體積(V)的關系如圖所示.下列敘述不正確的是( )| A. | a點溶液中:水電離出的c(H+)=1×10-12mol/L | |
| B. | b點溶液中:c(H+)=1×10-7mol/L | |
| C. | c點溶液中:c(K+)=2[c(CO${\;}_{3}^{2-}$)+c(HCO3-)+c(H2CO3)] | |
| D. | d點溶液中:c(K+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$) |
分析 a點為氫氧化鉀溶液,a到c是生成碳酸鉀,b點是碳酸鉀和氫氧化鉀的混合溶液,c點是單一的碳酸鉀溶液,c到d是生成碳酸氫鉀,d點是碳酸氫鉀和碳酸的混合溶液,d點溶液呈中性,
A.a點溶液中的溶質是KOH,水電離出的c(H+)=10-pH;
B.常溫下,c(OH-)=1×10-7mol/L,溶液呈中性;
C.c點溶液中,當水電離出的OH-離子濃度最大時,說明此時的溶液是碳酸鉀溶液,根據碳酸鉀溶液中的物料守恒判斷;
D.d點溶液中,溶液呈中性,溶液中存在電荷守恒,根據電荷守恒判斷.
解答 解:a點為氫氧化鉀溶液,a到c是生成碳酸鉀,b點是碳酸鉀和氫氧化鉀的混合溶液,c點是單一的碳酸鉀溶液,c到d是生成碳酸氫鉀,d點是碳酸氫鉀和碳酸的混合溶液,d點溶液呈中性,
A.a點溶液中的溶質是KaOH,氫氧化鉀抑制了水的電離,溶液中氫離子是水電離的,則水電離出的c(H+)=10-pH=1×10-12mol•L-1,故A正確;
B.b點是強堿溶液對水的電離起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,故B錯誤;
C.c點溶液中,當水電離出的OH-離子濃度最大時,說明此時的溶液是碳酸鉀溶液,根據碳酸鉀溶液中的物料守恒可得:c(K+)=2[c(CO32-)+c(HCO3)+c(H2CO3)],故C正確;
D.d點溶液中水電離出的OH-離子濃度10-7mol/L,溶液呈中性,c(H+)=c(OH-),結合電荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),兩式相減得:c(K+)=2c(CO32-)+c(HCO3-),故D正確;
故選B.
點評 本題考查離子濃度大小比較,為高頻考點,明確溶液中的溶質及其性質是解本題關鍵,結合電荷守恒進行解答,注意計算堿性溶液中水電離出氫離子和氫氧根離子的方法.


 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:選擇題
| A. | 25.5g | B. | 39g | C. | 51g | D. | 106.5g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5%蔗糖溶液 | B. | 75%乙醇溶液 | ||
| C. | 0.5mol/LNaCl溶液 | D. | 1mol/LNaCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
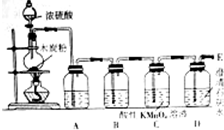 在100mL 18.4mol•L-1濃硫酸中加入1.2g木炭粉,加熱使之充分反應.并按如圖的裝置圖進行實驗,依次檢驗反應得到的產物,請回答下列問題:
在100mL 18.4mol•L-1濃硫酸中加入1.2g木炭粉,加熱使之充分反應.并按如圖的裝置圖進行實驗,依次檢驗反應得到的產物,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com