

分析 根據題中提示可知C為CaO,D為CO2,固體B是生活中的一種必需品,可由海水暴曬過濾得到,推測B為NaCl;NaCl與NH3、CO2、H2O反應可由得到化肥E和沉淀F,根據侯氏制堿法知識可以推測E為NH4Cl,F為NaHCO3,母液與CaO反應得到可以煅燒的物質H,可以推知母液中參與反應的主要物質為MgCl2,H為Mg(OH)2,G為CaCl2,I為MgO,結合N是一種常見金屬單質,推測N為Mg,結合題中第(5)問可以推測K為MgCl2,則M為Cl2,J為鹽酸,L為H2.
(1)根據圖中的物質轉化來逐步推理;
(2)煅燒貝殼時生成的氣體D可以在反應①中循環使用;
(3)根據侯氏制堿法的原理書寫;NH3在水中的溶解度大,先通入NH3,有利于吸收CO2;
(4)沉淀F為NaHCO3,受熱容易分解而得到化工產品Na2CO3;
(5)K為MgCl2,屬于強酸弱堿鹽,蒸發結晶時,鎂離子易水解而使其溶液呈酸性,應通入氯化氫抑制其水解.
解答 解:(1)煅燒貝殼(主要成分是碳酸鈣)得到的固體C是CaO,D必然是氣體CO2;海水曬鹽后得到的固體B必然是氯化鈉,母液中含有大量的溴離子、鎂離子等;CaO與母液的水反應生成氫氧化鈣,氫氧化鈣與母液中的鎂離子反應生成氫氧化鎂H,G為CaCl2,煅燒氫氧化鎂得到MgO,MgO與鹽酸反應得到氯化鎂,進而得到無水氯化鎂,從而電解熔融狀態的氯化鎂得到鎂單質N和M,則N為Mg單質,M為Cl2,與L可生成鹽酸,則L為H2;
故答案為:CaCl2;H2;調味品;
(2)煅燒貝殼時生成的氣體D(CO2),可以在反應①中循環使用,
故答案為:CO2;
(3)固體B是氯化鈉,D是CO2,二者與氨氣、水反應,符合侯氏制堿法的道理,即它們反應生成碳酸氫鈉和氯化銨,即CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;NH3極易溶解于水,容易吸收CO2,使其轉化為(NH4)2CO3,
故答案為:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;NH3在溶液中的溶解度大,利于吸收CO2,使其轉化為(NH4)2CO3;
(4)沉淀F為NaHCO3,受熱容易分解而得到化工產品Na2CO3,化學方程式為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,
故答案為:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O;
(5)氯化鎂是強酸弱堿鹽,蒸發結晶時,鎂離子易水解,水解離子方程式為MgCl2+H2O?Mg(OH)2+2HCl,為了防止HCl是揮發,應在氯化氫氣流中蒸發結晶,從而抑制氯化鎂水解;電解熔融氯化鎂方程式為:MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑,
故答案為:MgCl2溶液必須在氯化氫氣體中進行蒸發結晶制得MgCl2晶體,熔融電解可制取金屬鎂.
點評 本題考查海水的綜合利用,解答本類題目要抓住已知物質去逐步分析,當然在有些題目也要根據物質的顏色、生成的沉淀等推理,可以細心研究本題,總結該類題目的解題方法,做到觸類旁通,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | CH2=CH2 | B. | HC≡CH | C. | CH2=C(CH3)2 | D. | HC≡C-CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵絲在氯氣中燃燒:Fe+Cl2$\frac{\underline{\;點燃\;}}{\;}$FeCl2 | |
| B. | 常溫下,0.1mol/L醋酸溶液pH≈3 CH3COOH?CH3COO-+H+ | |
| C. | 鋁片放入氫氧化鈉溶液中有氣體產生 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | 蔗糖與濃硫酸混合產生刺激性氣味的氣體 C+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
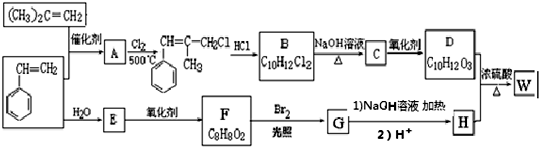
 .
.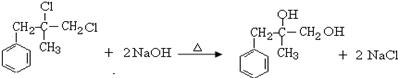 ;由D生成高分子化合物的方程式為
;由D生成高分子化合物的方程式為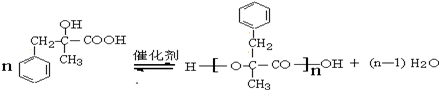 .
.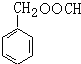 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
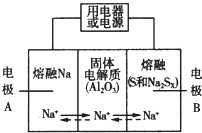 鈉硫電池以熔融金屬Na、熔融S和多硫化鈉(Na2SX)分別作為兩個電極的反應物,多孔固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖所示:
鈉硫電池以熔融金屬Na、熔融S和多硫化鈉(Na2SX)分別作為兩個電極的反應物,多孔固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖所示:| 物質 | Na | S | Al2O3 |
| 熔點/℃ | 97.8 | 115 | 2050 |
| 沸點/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應為吸熱反應 | |
| B. | 該反應中,SO2為還原劑 | |
| C. | 1 mol H2S中含有的共價鍵的數目為3 mol | |
| D. | 常溫下,H2S的還原性強于S的還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 能源是制約國家發展進程的因素之一.甲醇、二甲醚等被稱為2 1世紀的綠色能源,工業上利用天然氣為主要原料與二氧化碳、水蒸氣在一定條件下制備合成氣(CO、H2),再制成甲醇、二甲醚.
能源是制約國家發展進程的因素之一.甲醇、二甲醚等被稱為2 1世紀的綠色能源,工業上利用天然氣為主要原料與二氧化碳、水蒸氣在一定條件下制備合成氣(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩種溶液中由水電離出來的c(H+)不相同 | |
| B. | 將兩溶液等體積混合,則c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分別用蒸餾水稀釋m倍和n倍,若兩溶液pH仍相同,則m<n | |
| D. | 中和相同體積的兩種酸溶液所需NaOH的物質的量相同 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com