
| A. | 高溫下二氧化硅與碳酸鈉反應放出二氧化碳,說明硅酸(H2SiO3)的酸性比碳酸強 | |
| B. | 陶瓷、玻璃、水泥容器都能貯存氫氟酸 | |
| C. | 石灰抹墻、水泥砌墻的硬化過程原理不相同 | |
| D. | 硫酸鈉溶液、燒堿溶液、硝酸溶液、濃硫酸四種溶液均能用帶玻璃塞的試劑瓶保存 |
分析 A.根據反應條件分析,該反應條件不是常溫下溶液中,所以不能據此判斷酸性強弱;
B.根據陶瓷、玻璃、水泥容器的成分分析,二氧化硅能和HF反應;
C.石灰抹墻硬化是利用氫氧化鈣和二氧化碳的反應,水泥砌墻是利用水泥的凝固性;
D.玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和強堿反應,能和氫氟酸反應,帶玻璃塞的試劑瓶不能存放呈強堿性的物質;
解答 解:A.高溫條件下,雖然二氧化硅和碳酸鈉反應生成二氧化碳,但該反應條件是高溫而不是常溫,所以不能據此判斷酸性強弱,應根據溶液中進行的反應來判斷,故A錯誤;
B.陶瓷、玻璃、水泥的主要成分都是硅酸鹽,玻璃中含有二氧化硅,二氧化硅和HF反應生成SiF4,所以不能用玻璃容器盛放HF,故B錯誤;
C.石灰抹墻硬化發生的反應為Ca(OH)2+CO2=CaCO3↓+H2O,水泥砌墻是利用水泥的凝固性,所以原理不同,故C正確;
D.硫酸鈉溶液,不和二氧化硅反應,所以可以帶玻璃塞的試劑瓶盛放,硝酸呈酸性,不和二氧化硅反應,所以可以帶玻璃塞的試劑瓶盛放,濃硫酸呈酸性,不和二氧化硅反應,所以可以帶玻璃塞的試劑瓶盛放,氫氧化鈉呈強堿性,能和二氧化硅反應生成硅酸鈉,硅酸鈉具有黏性,能把玻璃塞黏住,所以不可以帶玻璃塞的試劑瓶盛放,故D錯誤;
故選C.
點評 本題考查了無機非金屬材料硅及其化合物的性質,陶瓷、玻璃、水泥容器和強酸不反應,但能和氫氟酸反應,所以不能用陶瓷、玻璃、水泥容器貯存氫氟酸,注意D化學試劑的存放,題目難度不大.


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用氯氣和消石灰制漂白粉 | B. | 鋁熱法冶煉金屬釩 | ||
| C. | 用石灰石、純堿、二氧化硅制玻璃 | D. | 電解飽和食鹽水制燒堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 呈酸性 | B. | 呈中性 | C. | 呈堿性 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
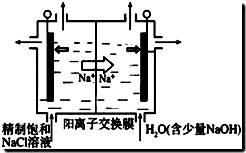
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
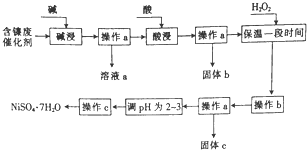 某化學小組通過查閱資料,設計了如圖所示的方法以含鎳廢催化劑為原料來制備NiSO4•7H2O,已知某化工廠的含鎳廢催化劑主要含有Ni,還含有Al(31%)、Fe(1.3%)的單質及氧化物,其他不溶雜質(3.3%).
某化學小組通過查閱資料,設計了如圖所示的方法以含鎳廢催化劑為原料來制備NiSO4•7H2O,已知某化工廠的含鎳廢催化劑主要含有Ni,還含有Al(31%)、Fe(1.3%)的單質及氧化物,其他不溶雜質(3.3%).| 沉淀物 | 開始沉淀時的pH | 完全沉淀時的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸是鉛蓄電池的電解質溶液,鉛蓄電池可實現化學能轉變成電能 | |
| B. | 硅酸干凝膠是硅酸干燥劑的主要成分,作用是吸收水分 | |
| C. | 肥皂的主要成分是硬脂酸鈉,可以用于除去油污 | |
| D. | 二氧化硅是光能轉化為電能的轉化材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 金屬 | 顏色 | 密度(g/cm3) | 熔點(℃) | 沸點(℃) | 比熱[KJ/kg•℃] |
| Fe | 銀白色 | 7.86 | 1 535 | 2 750 | 0.44 |
| Cu | 紅色 | 8.92 | 1 083 | 2 567 | 0.38 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
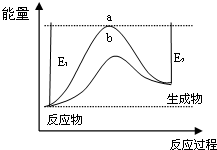
| 濃度/mol•L-1 時間 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com