
| A、Cl2+H2O=HCl+HclO | ||||
B、3Fe+4H2O(g)
| ||||
C、C+H2O
| ||||
| D、Na2O+H2O=2NaOH |


 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 工業上以黃鐵礦為原料生產硫酸主要分為三個階段進行,即煅燒、催化氧化、吸收.請回答下列個問題:
工業上以黃鐵礦為原料生產硫酸主要分為三個階段進行,即煅燒、催化氧化、吸收.請回答下列個問題:| 催化劑 | △ |
查看答案和解析>>
科目:高中化學 來源: 題型:

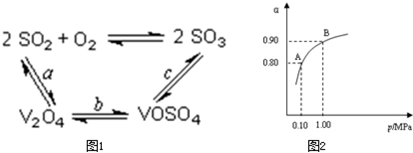
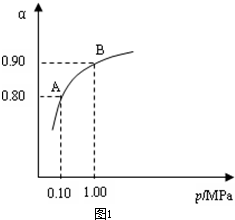
(1)催化氧化所使用的催化劑釩觸媒(V2O5)能加快二氧化硫氧化速率,此過程中產生了一連串的中間體(如圖)。其中a、c二步的化學方程式可表示為:___________________________、________________________。
(2)

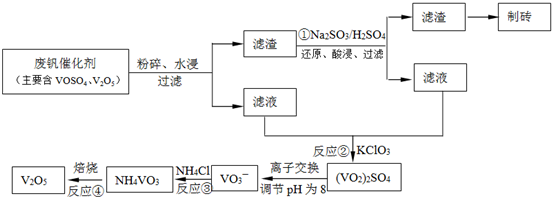
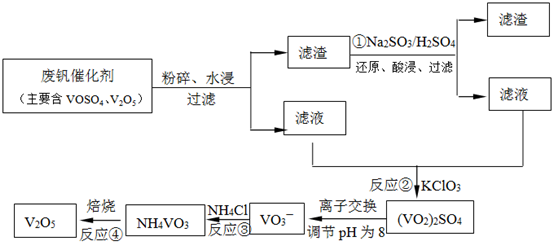
(3)為循環利用催化劑,科研人員最新研制了一種離子交換法回收釩的新工藝,回收率達91.7%以上。已知廢釩催化劑中含有V2O5、VOSO4及不溶性殘渣。查閱資料知:VOSO4可溶于水,V2O5難溶于水,NH4VO3難溶于水。該工藝的流程如下圖。

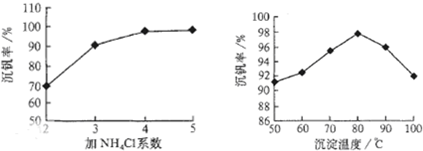
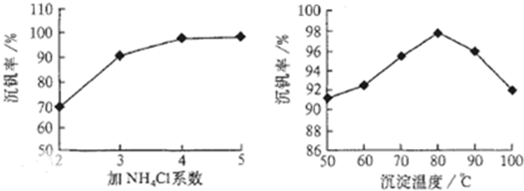
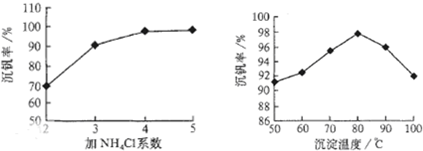
則:反應①②③④中屬于氧化還原反應的是____________(填數字序號),反應①的離子方程式為____________________________________。該工藝中反應③的沉淀率(又稱沉釩率)是回收釩的關鍵之一,沉釩率的高低除受溶液pH影響外,還需要控制氯化銨計量數(NH4Cl加入質量與料液中V2O5的質量比)和溫度。根據下圖試建議控制氯化銨計量數和溫度:____________、____________。

查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源:2011年福建省高考化學模擬試卷(三)(解析版) 題型:解答題
 2SO3(g);△H<0
2SO3(g);△H<0


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com