解:(1)以黃鐵礦為原料生產硫酸主要分為三個階段進行,即煅燒、催化氧化、吸收;其中二氧化硫的催化氧化在催化劑表面和空氣中的氧氣接觸反應,若氣體中含有雜質氣體容易使催化劑中毒,所以煅燒黃鐵礦形成的爐氣必須經除塵、洗滌、干燥;故答案為:接觸室,防止催化劑中毒.
(2)依據圖1中的轉化關系,V
2O
5參與反應先做氧化劑把二氧化硫氧化為三氧化硫,本身被還原為圖中產物V
2O
4;根據氧化還原反應的實質寫出并配平a步化學方程式SO
2+V
2O
5?SO
3+V
2O
4;C是VOSO
4轉化為SO
3,此過程需要重新生成催化劑V
2O
5,需要氧化劑完成,此過程中的氧化劑時氧氣,根據化合價的變化寫出C步化學方程式 4VOSO
4+O
2?2V
2O
5+4SO
3;故答案為:4VOSO
4+O
2?2V
2O
5+4SO
3(3)2SO
2+O
2
2SO
3 體系總壓強為0.10M Pa,此時二氧化硫的轉化率為80%
2SO
2 +O
2
2SO
3 起始量(mol) 2 1 0
變化量(mol) 2×0.8 0.8 2×0.8
平衡量(mol) 0.4 0.2 1.6
平衡時各物質的濃度為:[SO
2]=0.08mol/L,[O
2]=0.04mol/L,[SO
3]=0.32mol/L,代入平衡常數的計算式得到平衡常數K=
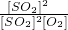
=400 L?mol
-1,
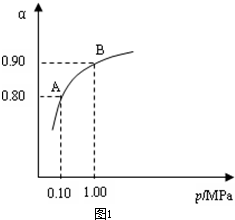
從圖象中可以看出,常壓SO
2就可以達到較高的轉化率,壓強的增加引起SO
2轉化率的變化并不明顯,所以工業上直接采用常壓;
故答案為:400 L?mol
-1,使用常壓SO
2就可以達到較高的轉化率;
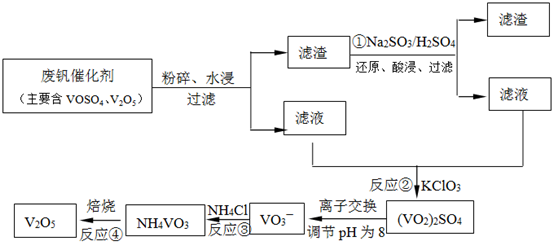
(4)依據離子交換法回收釩的新工藝流程圖分析反應過程中:
①的目的是把難溶的五氧化二釩還原為溶于水的VOSO
4;
②的目的是用KClO
3還原為VOSO
4為(VO
2)
2SO
4;
③因為NH
4VO
3難溶于水,此步驟的目的是沉淀VO
3-④是分解NH
4VO
3得到V
2O
5;
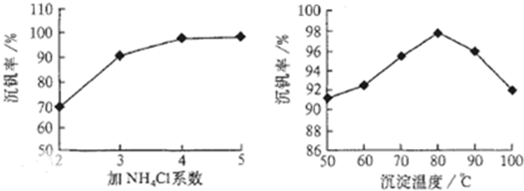
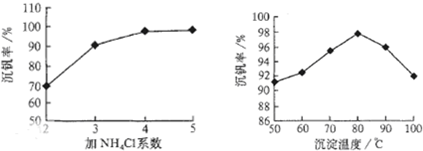
工藝中反應③的沉淀率(又稱沉礬率)是回收釩的關鍵之一,沉釩率的高低除受溶液pH影響外,還需要控制氯化銨系數(NH
4Cl加入質量與料液中V
2O
5的質量比)和溫度.根據圖示分析數據,80℃時沉礬率最高為98%,所以加NH
4Cl的系數從圖中讀出為4;
故答案為:①②;V
2O
5+SO
32-+4H
+=2VO
2++SO
42-+2H
2O;4和80℃;
分析:(1)煅燒黃鐵礦形成的爐氣主要是二氧化硫氣體,進入接觸室前必須對氣體繼續除塵、洗滌、干燥,防止催化劑中毒,影響催化氧化的效果;
(2)根據催化劑參與反應過程生成的中間產物,分析催化劑參與反應,最終重新生成來書寫化學方程式;
(3)根據化學平衡計算的三段式進行計算,壓強的增加引起SO
2轉化率的變化并不明顯,所以工業上直接采用常壓;
(4)根據流程中釩元素的存在化合物中的化合價的變化,判斷出發生氧化還原反應的是①②;反應①是利用亞硫酸鈉在酸性溶液中的還原性把難溶的V
2O
5轉化為易溶于水的VOSO
4便于釩的提取;根據圖1和圖2分析坐標系中的表示含義,結合圖②中的沉礬率在80度C時最大,約為98%,在圖①中找到對應沉礬率98%下的控制氯化銨系數為4.
點評:本題考查了工業制硫酸的生產步驟、原理應用、注意問題,化學平衡的應用和條件選擇,利用信息進行判斷和書寫化學方程式的能力,圖象分析能力,提取釩元素的流程分析和氧化還原反應的應用.



 2SO3 體系總壓強為0.10M Pa,此時二氧化硫的轉化率為80%
2SO3 體系總壓強為0.10M Pa,此時二氧化硫的轉化率為80% 2SO3
2SO3 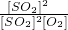 =400 L?mol-1,
=400 L?mol-1,

 全優考典單元檢測卷及歸類總復習系列答案
全優考典單元檢測卷及歸類總復習系列答案
 工業上以黃鐵礦為原料生產硫酸主要分為三個階段進行,即煅燒、催化氧化、吸收.請回答下列個問題:
工業上以黃鐵礦為原料生產硫酸主要分為三個階段進行,即煅燒、催化氧化、吸收.請回答下列個問題: