
【題目】在一定溫度下,向體積恒定為2L的密閉容器里充入2mol M和一定量的N,發生如下反應:M(g)+N(g)![]() E(g),當反應進行到4min時達到平衡,測得M的濃度為0.2mol·L-1。下列說法正確的是( )
E(g),當反應進行到4min時達到平衡,測得M的濃度為0.2mol·L-1。下列說法正確的是( )
A.2min時,M的物質的量濃度為0.6mol·L-1
B.0~4min內,v(M)=0.8mol·L-1·min-1
C.4min后,向容器中充入不參與反應的稀有氣體,M的物質的量減小
D.4min時,M的轉化率為80%
 勵耘書業暑假銜接寧波出版社系列答案
勵耘書業暑假銜接寧波出版社系列答案科目:高中化學 來源: 題型:
【題目】以下實驗設計能達到實驗目的的是( )
選項 | 實驗目的 | 實驗設計 |
A | 證明非金屬性強弱:Cl>C>Si |
|
B | 鑒別NaBr和KI溶液 | 分別加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固體中的Na2CO3 | 將固體加熱至恒重 |
D | 證明相同溫度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸銀溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出現白色沉淀,再加入 幾滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】治理汽車尾氣和燃煤尾氣是環境保護的重要課題.請回答下列問題:
(1)在汽車排氣系統中安裝三元催化轉化器,可發生反應:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在恒容密閉容器中通入等量的CO和NO,發生上述反應時,c(CO)隨溫度(T)和時間(t)的變化曲線如圖所示.
2CO2(g)+N2(g).在恒容密閉容器中通入等量的CO和NO,發生上述反應時,c(CO)隨溫度(T)和時間(t)的變化曲線如圖所示.
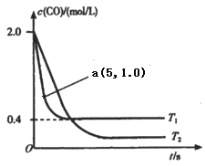
①據此判斷該反應的正反應為____(填“放熱”或“吸熱”)反應.
②溫度T1時,該反應的平衡常數K=_____;反應速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分別為正、逆反應速率常數,計算a處v(正):v(逆)=________.
(2)下圖流程是一種新型的除去尾氣中氮氧化物的技術,一般采用氨氣或尿素作還原劑
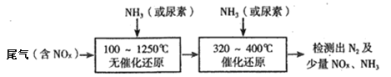
該技術中用尿素[CO(NH2)2]作還原劑還原NO2的主要反應為:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O ,則用NH3作還原劑還原尾氣中NO(NH3、NO的物質的量之比為1:1)的化學方程式為:______.
4CO2+7N2+8H2O ,則用NH3作還原劑還原尾氣中NO(NH3、NO的物質的量之比為1:1)的化學方程式為:______.
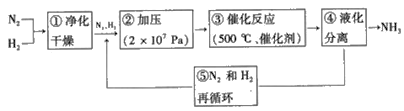
(3)哈伯法合成氨的流程圖如圖,下列五個流程中為提高原料利用率而采取的措施________(填序號)
(4)一種電化學制備NH3的裝置如圖所示,圖中陶瓷在高溫時可以傳輸H+.下列敘述正確的是______________(填選項)
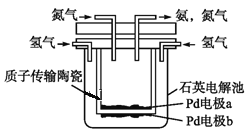
A.Pd電極b為陰極 B.陰極的反應式為N2+6H++6e-=2NH3
C.H+由陽極向陰極遷移 D.陶瓷可以隔離N2和H2
(5)也可用CH4催化還原NOx法消除煙氣中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
則CH4催化還原NO的熱化學方程式為__________________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有Na2SO3、Na2S04混合物樣品ag,為了測定其中Na2SO3的質量分數,設計了如下方案,其中明顯不合理的是
A. 將樣品配制成溶液V1L,取其中25.00 mL用標準KMn04溶液滴定,消耗標準 KMn04 溶液V2 mL
B. 向樣品中加足量H202,再加足量BaCl2溶液,過濾,將沉淀洗滌、干燥,稱量其質量為bg
C. 將樣品與足量稀鹽酸充分反應后,再加入足量BaCl2溶液,過濾,將沉淀洗滌、干燥,稱量其質量為c g
D. 將樣品與足量稀鹽酸充分反應,生成的氣體依次通過盛有飽和NaHS03的洗氣瓶、盛有濃H2S04的洗氣瓶、盛有堿石灰的干燥管I、盛有堿石灰的干燥管II,測得干燥管I增重dg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇能發生如下反應:
①![]() ;
;
②![]() ,
,![]() 。
。
由以上反應得出的結論錯誤的是( )
A.由反應①②可知,條件不同,乙醇與![]() 反應的產物不同
反應的產物不同
B.由反應②可知,![]() 是乙醇氧化生成乙醛的催化劑
是乙醇氧化生成乙醛的催化劑
C.由反應①可知,乙醇燃燒時,碳碳鍵、碳氫鍵、碳氧鍵 、氫氧鍵均斷裂
D.由反應②可知,乙醇氧化為乙醛時,只斷開氫氧鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定條件下于密閉容器中達到平衡。下列各項措施中,不能提高乙烷平衡轉化率的是( )
C2H4(g)+H2(g) △H>0,在一定條件下于密閉容器中達到平衡。下列各項措施中,不能提高乙烷平衡轉化率的是( )
A. 增大容器容積B. 升高反應溫度
C. 分離出部分氫氣D. 等容下通入惰性氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,在氨
時,在氨![]() 水體系中不斷通入
水體系中不斷通入![]() ,各種離子變化趨勢如圖所示。下列說法不正確的是
,各種離子變化趨勢如圖所示。下列說法不正確的是

A.當![]() 時,會有中間產物
時,會有中間產物![]() 生成
生成
B.在![]() 時,溶液中存在關系:
時,溶液中存在關系:![]()
C.在![]() 時,溶液中存在關系:
時,溶液中存在關系:![]()
D.隨著![]() 的通入,
的通入,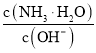 不斷減小
不斷減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是阿伏加德羅常數的值,下列說法正確的是
是阿伏加德羅常數的值,下列說法正確的是
A.標準狀況下,![]() 無水乙醇所含碳氫鍵數目為
無水乙醇所含碳氫鍵數目為![]()
B.足量![]() 與含
與含![]() 的濃鹽酸完全反應,轉移電子數為
的濃鹽酸完全反應,轉移電子數為![]()
C.標準狀況下,![]() 氦氣和氖氣的混合氣體中原子數為
氦氣和氖氣的混合氣體中原子數為![]()
D.含![]() 和
和![]() 共
共![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 數目為
數目為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z的原子序數依次增大。由這些元素組成的四種常見10電子微粒A、B、C、D的轉化關系如圖所示(條件已省略),其中B、D的組成元素相同,D為常見無色液體。下列有關說法一定錯誤的是( )

A.若A為氫化物,則熱穩定性:A>D
B.若A為氫化物,則簡單離子半徑:Z>Y
C.若C為氫化物,則熔沸點:C<D
D.若C為氫化物,則X、Z形成的化合物中可能存在非極性鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com