
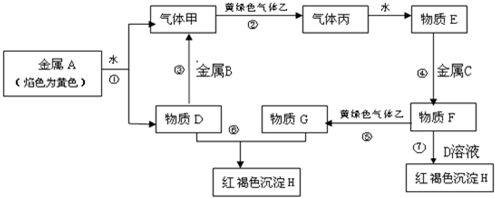
分析 金屬A焰色反應為黃色,故A為金屬Na,乙是黃綠色氣體,乙為Cl2,H為紅褐色沉淀,為Fe(OH)3;由反應①Na→氣體甲+D,考慮Na與水的反應,故甲為H2,D為NaOH,由NaOH+金屬B→H2可知,B為金屬Al,由甲+乙→丙,故丙為HCl,HCl溶于水的物質E,故E為鹽酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(鹽酸)$\stackrel{金屬C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C為Fe,F為FeCl2,G為FeCl3,FeCl2與氫氧化鈉在空氣中生成氫氧化鐵,符合各物質的轉化關系,以此解答該題.
解答 解:金屬A焰色反應為黃色,故A為金屬Na,乙是黃綠色氣體,乙為Cl2,H為紅褐色沉淀,為Fe(OH)3;由反應①Na→氣體甲+D,考慮Na與水的反應,故甲為H2,D為NaOH,由NaOH+金屬B→H2可知,B為金屬Al,由甲+乙→丙,故丙為HCl,HCl溶于水的物質E,故E為鹽酸;G+NaOH→Fe(OH)3,G含有Fe3+,由E(鹽酸)$\stackrel{金屬C}{→}$F$\stackrel{Cl_{2}}{→}$G可知,C為Fe,F為FeCl2,G為FeCl3,FeCl2與氫氧化鈉在空氣中生成氫氧化鐵,
(1)由以上分析可知A為Na,F為FeCl2,故答案為:Na;FeCl2;
(2)氯氣具有強氧化性,可用于殺菌消毒,也可制備鹽酸,故答案為:自來水消毒或制造鹽酸;
(3)氯化鐵、鹽酸溶液的顏色不同,可用氫氧化鈉反應,可也用KSCN溶液鑒別,
故答案為:觀察兩種溶液顏色;硫氰化鉀溶液或氫氧化鈉溶液;
(4)鈉和水反應的離子方程式為2Na+2H2O=2Na++2OH-+H2↑,故答案為:2Na+2H2O=2Na++2OH-+H2↑;
(5)反應⑦為FeCl2與氫氧化鈉在空氣中生成氫氧化鐵,反應的化學方程式為FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案為:FeCl2+2NaOH=2NaCl+4Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
點評 本題考查無機物的推斷,為高頻考點,把握紅褐色沉淀、鋁熱反應、Fe和Al的化合物性質為解答的關鍵,側重分析、推斷及應用能力的考查,綜合性較強,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 實驗室利用石灰石與稀鹽酸制取CO2:CO32-+2H+=CO2↑+H2O | |
| B. | 氯氣與H2O的反應:Cl2+H2O=2H++Cl-+ClO- | |
| C. | Ba(OH)2溶液與稀H2SO4混合:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化鈉與鹽酸反應:Na2O+2H+=2Na++H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣與水發生反應,氯氣在反應中減少1mol,溶液中生成的HClO分子數恰好為NA | |
| B. | 標準狀況下,足量的Fe與2.24 L Cl2反應轉移電子的數目為0.3NA | |
| C. | 100 mL pH=2的新制氯水中:N(OH-)+2N(ClO-)+N(HClO)=0.001 NA | |
| D. | 1.6 g CH4含有共用電子對的數目為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑逐漸減小 | B. | 元素原子得電子能力逐漸增強 | ||
| C. | 氣態氫化物穩定性逐漸增強 | D. | 最高化合價逐漸增高 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃H2SO4有氧化性,稀H2SO4無氧化性 | |
| B. | 由于濃H2SO4具有吸水性,故可用來與蔗糖反應做“黑面包”實驗 | |
| C. | 稀H2SO4與鐵、鋁反應,濃H2SO4在常溫下不與鐵、鋁反應 | |
| D. | 濃硫酸與銅片加熱反應,既表現了酸性,又表現出強氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 方案 | 操作過程及現象 |
| 甲 | 向第l支試管中滴加稀鹽酸,將產生的氣體通入溴水中,溴水褪色 |
| 乙 | 向第2支試管中滴加稀鹽酸,將產生的氣體分別通入品紅溶液、CuSO4溶液中,品紅溶液無變化,CuSO4溶液中產生黑色沉淀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com