
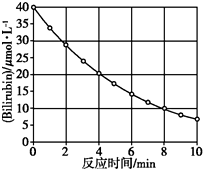
 化合物Bilirubin在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如圖所示,計算反應4~8 min間的平均反應速率和推測反應16 min時反應物的濃度,結果應是( )
化合物Bilirubin在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如圖所示,計算反應4~8 min間的平均反應速率和推測反應16 min時反應物的濃度,結果應是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
分析 根據v=$\frac{△c}{△t}$計算反應4~8min間的平均反應速率;0~4 min期間,反應物濃度變化為(40-20)μmol/L=20μmol/L,4~8 min期間,反應物濃度變化為(20-10)μ mol/L=10μmol/L,可知,每隔4分鐘,速率降為原來的一半,據此計算.
解答 解:由圖可知,4~8 min期間,反應物濃度變化為(20-10)μ mol/L=10μmol/L,
所以4~8 min期間,反應速率為$\frac{10μmol/L}{4min}$=2.5μ mol/(L•min);
由圖可知,0~4 min期間,反應物濃度變化為(40-20)μmol/L=20μmol/L,4~8 min期間,反應物濃度變化為(20-10)μ mol/L=10μmol/L,可知,每隔4分鐘,濃度變化量降為原來的一半,所以8~12min濃度變化為5μ mol/L,12~16min濃度變化為2.5μ mol/L,
所以16min時濃度為10μ mol/L-5μ mol/L-2.5μ mol/L=2.5μ mol/L.
故選B.
點評 本題考查反應速率的有關計算,難度中等,根據圖中濃度變化判斷相同時間內的濃度變化量是解題關鍵.


科目:高中化學 來源: 題型:解答題
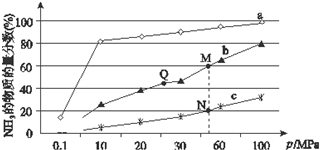 合成氨反應是化學上最重要的反應之一:
合成氨反應是化學上最重要的反應之一:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
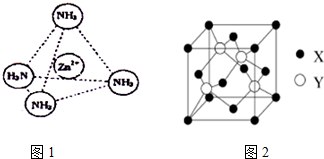
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有第2列元素的原子最外層有2個電子 | |
| B. | 第14列元素形成化合物種類最多 | |
| C. | 第3列元素種類最多 | |
| D. | 第17、18列元素都是非金屬元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com