

分析 (1)相鄰原子之間通過強烈的共價鍵結合而成的空間網狀結構的晶體叫做原子晶體,其構成微粒是原子;不同類型晶體熔沸點高低的比較:一般來說,原子晶體>離子晶體>分子晶體;分子晶體中含有氫鍵的熔沸點較高;同種類型的分子晶體相對分子質量越大,熔沸點越高;
(2)生產硅烷的反應為可逆反應,抽成真空,能使反應平衡正移,有利于生產硅烷;
(3)根據氨的性質分析:氨氣易液化,液氨氣化時能從周圍環境吸熱降溫;
(4)依據熱化學方程式的書寫方法分析書寫,反應熱與化學計量數成正比;
(5)根據書寫化學方程式的步驟:寫配注等,正確書寫方程式即可,三硅酸鎂和鹽酸反應生成氯化鎂、二氧化硅和水,根據化學方程式進行計算Mg2Si3O8•nH2O中n的值.
解答 解:(1)相鄰原子之間通過強烈的共價鍵結合而成的空間網狀結構的晶體叫做原子晶體,其構成微粒是原子;原子晶體具有熔點高和硬度大的特點,氮化硅(Si3N4)是一種耐高溫材料,說明氮化硅屬于原子晶體,NH3、Si3N4和SiH4三種物質,Si3N4為原子晶體,NH3、SiH4是分子晶體,則熔沸點順序為:Si3N4>NH3、SiH4,NH3中含有氫鍵、SiH4中不含氫鍵,所以NH3的熔沸點較高,即Si3N4>NH3>SiH4,
故答案為:原子;Si3N4>NH3>SiH4;
(2)生產硅烷的反應為4NH4Cl+Mg2Si$\stackrel{常溫}{?}$4NH3↑+SiH4↑+2MgCl2,該反應為可逆反應,正反應為氣體體積增大的反應,抽成真空,有利于反應平衡正向移動,有利于生產硅烷,
故答案為:使4NH4Cl+Mg2Si$\stackrel{常溫}{?}$4NH3↑+SiH4↑+2MgCl2平衡正移,有利于生產硅烷;
(3)氨氣易液化,液氨氣化時能從周圍環境吸熱降溫,上述生產硅烷的過程中液氨的作用是:吸收熱量,保證反應在常溫下進行,
故答案為:吸收熱量,保證反應在常溫下進行(答“制冷”或“降溫”均可);
(4)氨氣催化氧化反應生成一氧化氮和水,反應的化學方程式為:4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O,1mol氨氣在一定溫度下(T>150℃)發生催化氧化反應能釋放出226.5kJ的熱量,則4mol氨氣在一定溫度下(T>150℃)發生催化氧化反應能釋放出226.5kJ×4=906KJ的熱量,所以該反應的熱化學方程式是:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol,
故答案為:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906.0 kJ/mol;
(5)三硅酸鎂中和胃酸(HCl)的化學方程式為:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,根據化學方程式,設0.184gMgSi3O8•nH2O的物質的量是x,得
MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O
1 4
x 0.050L×1mol/L-0.030L×1mol/L
$\frac{1}{x}$=$\frac{4}{0.050L×1mol/L-0.030L×1mol/L}$,
解得x=0.005mol,所以MgSi3O8•nH2O的摩爾質量是M=$\frac{m}{n}$=$\frac{1.84}{0.005}$=368g/mol,Mg2Si3O8的摩爾質量為260g/mol,所以18n=108,即n=6.
故答案為:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O;6.
點評 本題考查較為綜合,涉及硅、氮及其化合物的性質以及工業流程的理解、復雜化學式的確立等知識,要求學生具有較強的分析和解決問題的能力,明確反應原理是解答本題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 維勒用無機物合成了尿素,突破了無機物和有機物的界限 | |
| B. | 石油裂解的目的是提高汽油等輕質油的產量和質量 | |
| C. | 羥基不帶電,氫氧根帶一個單位負電荷,氫氧根比羥基穩定 | |
| D. | 苯分子中不存在單雙鍵交替的事實是苯的鄰二取代物沒有同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Ⅰ.甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,觀察A中,發現溶液先呈紅色,然后變為黃色.
Ⅰ.甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,觀察A中,發現溶液先呈紅色,然后變為黃色. .甲同學猜想SCN-可能被Cl2氧化了,他進行了如下研究;
.甲同學猜想SCN-可能被Cl2氧化了,他進行了如下研究; ,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應的離子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應的離子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;| 步驟:分別取等體積、等濃度的含氰廢水于甲、乙兩支試管中,再分別加入等體積、等濃度的雙氧水溶液,只向甲試管中加入少量的無水硫酸銅粉末,用離子色譜儀測定相同反應時間內兩支試管中的CN-濃度 | 現象與結論: 若甲試管中的CN-濃度小于乙試管中的CN-濃度,則Cu2+對雙氧水破氰反應起催化作用 若兩試管中的CN-濃度相同,則Cu2+對雙氧水破氰反應不起催化作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 少量酒精在空氣中揮發不見了;少量酒精在空氣中燃燒后消失 | |
| B. | 塊狀生石灰在空氣中逐漸變成粉末;晶體碳酸鈉在空氣中逐漸變成粉末 | |
| C. | 木炭燃燒發光、發熱;電燈發光、發熱 | |
| D. | 石灰水中通入少量CO2后變渾濁;室溫下的飽和石灰水加熱后變渾濁 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯的結構簡式為:CH2=CH2 | |
| B. | 乙醇的結構式為: | |
| C. | 用電子式表示Na2S的形成過程可表示為: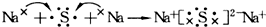 | |
| D. | 丙烷的比例模型為: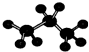 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | H-H | N≡N | N-H |
| 鍵能(kJ/mol) | 436 | 946 | 391 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com