
分析 A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數依次增大,A原子核外有三個未成對電子,其電子排布式為1S22S22P3,為N元素,元素B的氫化物能用于刻蝕玻璃,則B為F元素,C元素是地殼中含量最高的金屬元素,則C為Al元素,D原子核外的M層中只有兩對成對電子,電子排布式為1S22S22P63S23P4,應為S元素,E原子核外最外層只有1個電子,其余各層電子均充滿,原子序數大于硫,則E的電子排布式為1S22S22P63S23P63d104S1,所以E為Cu元素,據此答題;
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數依次增大,A原子核外有三個未成對電子,其電子排布式為1S22S22P3,為N元素,元素B的氫化物能用于刻蝕玻璃,則B為F元素,C元素是地殼中含量最高的金屬元素,則C為Al元素,D原子核外的M層中只有兩對成對電子,電子排布式為1S22S22P63S23P4,應為S元素,E原子核外最外層只有1個電子,其余各層電子均充滿,原子序數大于硫,則E的電子排布式為1S22S22P63S23P63d104S1,所以E為Cu元素,
(1)根據上面的分析可知,E為Cu元素,E的核外電子排布式是1s22s22p63s23p63d104s1(或[Ar]3d104s1),在元素周期表中,同一周期元素的第一電離能從左到右逐漸增大,同一主族元素的第一電離能從上到下逐漸減小,據此可判斷四種元素的第一電離能的順序為:Al<S<N<F,
故答案為:1s22s22p63s23p63d104s1(或[Ar]3d104s1);Al<S<N<F;
(2)化合物CA為AlN,C的氯化物為AlCl3,AlN為原子晶體而AlCl3為分子晶體,所以AlN的熔點遠高于AlCl3的熔點,
故答案為:AlN為原子晶體而AlCl3為分子晶體;
(3)A的最高價含氧酸根離子為NO3-,NO3-中氮原子的價層電子對數為$\frac{5+1}{2}$=3,所以氮原子采取sp2雜化,D的低價氧化物為SO2,由于分子中硫原子的價層電子對數為$\frac{6}{2}$=3,分子中有一對孤電子對,所以分子的空間構型是V形,
故答案為:sp2;V形;
(4)F2與NaOH溶液反應的產物之一是OF2,該反應的離子方程式為2F2+2OH-=OF2+2F-+H2O,
故答案為:2F2+2OH-=OF2+2F-+H2O.
點評 本題考查元素推斷題,推斷出元素的種類是解答本題的關鍵,推斷時注意從原子的核外電子排布特點以及元素的特殊性質為突破口解答,本題具有一定難度.


科目:高中化學 來源: 題型:選擇題

| A. | 一段時間后,銅棒上有紅色物質析出 | |
| B. | 正極反應為:Zn-2e-═Zn2+ | |
| C. | 在外電路中,電流從負極流向正極 | |
| D. | 鹽橋中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 下面是某化學學習小組的同學進行研究性學習的過程,請你參與并協助他們完成相關學習任務.
下面是某化學學習小組的同學進行研究性學習的過程,請你參與并協助他們完成相關學習任務.| 物質 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸點 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖中X、Y分別是直流電源的兩極,通電后發現a極板的質量增加,b極板上有無色無味的氣體產生.下列符合此現象的是( )
如圖中X、Y分別是直流電源的兩極,通電后發現a極板的質量增加,b極板上有無色無味的氣體產生.下列符合此現象的是( )| a極板 | b極板 | Y電極 | c溶液 | |
| A | 鋅 | 石墨 | 負極 | CuSO4 |
| B | 石墨 | 石墨 | 負極 | NaOH |
| C | 銀 | 鐵 | 正極 | AgNO3 |
| D | 石墨 | 石墨 | 負極 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
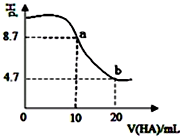 室溫下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的變化曲線如圖所示.下列說法正確的是( )
室溫下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的變化曲線如圖所示.下列說法正確的是( )| A. | HA為強酸 | |
| B. | a、b兩點所示溶液中水的電離程度相同 | |
| C. | b點所示溶液中c(A-)>c(HA) | |
| D. | pH=7時,c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com