
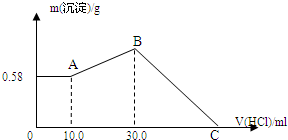
 把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后,產生0.58g白色沉淀,再向所得懸濁液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的體積與生成沉淀的關系如圖所示.
把NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后,產生0.58g白色沉淀,再向所得懸濁液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的體積與生成沉淀的關系如圖所示.分析 固體組成的混合物溶于足量水后,再加入鹽酸時,0-A時沉淀的質量不變,說明溶液中NaOH過量,加入10 mL 鹽酸恰好中和過量的NaOH,再加鹽酸沉淀增多,說明[Al(OH)4]-轉化為Al(OH)3,故A點沉淀物為 Mg(OH)2,其物質的量為$\frac{0.58g}{58g/mol}$=0.01mol,根據鎂原子守恒計算n(MgCl2);
AB段發生反應:[Al(OH)4]-+H+=Al(OH)3↓+H2O,B點溶液中存在的溶質是NaCl,沉淀為Mg(OH)2、Al(OH)3,B點后發生反應:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O;
由AB段消耗鹽酸,結合反應方程式、Al原子守恒計算n(AlCl3),B點溶液中存在的溶質是氯化鈉,根據原子守恒可知n(NaOH)=n(NaCl),則原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl);
C點溶液為MgCl2、AlCl3和NaCl混合液,由氯離子守恒可知,氯化鈉中氯離子源于加入鹽酸,根據鈉離子守恒可知m(NaOH)=n(NaCl),進而計算加入鹽酸的體積.
解答 解:(1)固體組成的混合物溶于足量水后,再加入鹽酸時,0-A時沉淀的質量不變,說明溶液中NaOH過量,加入10 mL 鹽酸恰好中和過量的NaOH,再加鹽酸沉淀增多,說明[Al(OH)4]-轉化為Al(OH)3,故A點沉淀物為 Mg(OH)2,其物質的量為$\frac{0.58g}{58g/mol}$=0.01mol,根據鎂原子守恒,n(MgCl2)=n[Mg(OH)2]=$\frac{0.58}{58g/mol}$=0.01mol;
AB段發生反應:[Al(OH)4]-+H+=Al(OH)3↓+H2O,則n[Al(OH)3]=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根據鋁原子守恒得n(AlCl3)=n[Al(OH)3]=0.01mol;
B點溶液中存在的溶質是NaCl,沉淀為Mg(OH)2、Al(OH)3,B點后發生反應:Al(OH)3+3H+=Al3++3H2O、Mg(OH)2+2H+=Mg2++2H2O,B點溶液中存在的溶質是NaCl,由Na+離子和Cl-離子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol,
故答案為:0.065mol;0.01mol;0.01mol;
(2)C點溶液為MgCl2、AlCl3和NaCl混合液,由氯離子守恒可知,氯化鈉中氯離子源于加入鹽酸,根據鈉離子守恒可知m(NaOH)=n(NaCl)=0.065mol,C點加入鹽酸的體積為$\frac{0.065mol}{0.5mol/L}$=0.13L=130mL,
故答案為:130.
點評 本題考查混合物有關計算,關鍵是明確每階段發生的反應,再結合原子守恒來分析解答,(2)注意從化學式變化來分析,側重考查學生分析計算能力,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 分子模型可以直觀地表現分子結構的特點.如圖表示某烴分子的一種模型,有關說法中正確的是( )
分子模型可以直觀地表現分子結構的特點.如圖表示某烴分子的一種模型,有關說法中正確的是( )| A. | 該圖表示的是乙烯分子的球棍模型 | |
| B. | 該烴分子是非極性分子 | |
| C. | 該烴的電子式為: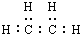 | |
| D. | 該烴分子中半徑較大的原子其核外電子排布的軌道表示式為: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
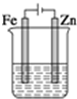
| A. | 溶液中氯離子向鋅電極移動 | B. | 鋅電極上生成氧化產物 | ||
| C. | 兩端電極產生相等體積的氣體 | D. | 電路中電子轉移數為0.4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
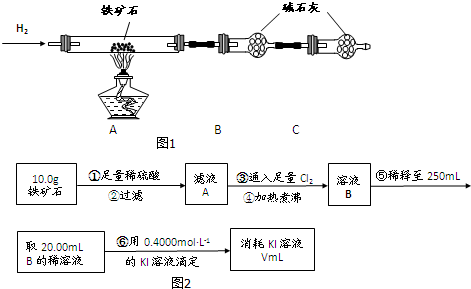
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 陰離子 | OH-、Cl-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol乙基中含有的電子數為13NA | |
| B. | 標準狀況下,22.4L三氯甲烷中共價鍵數目為4NA | |
| C. | 6.4gCaC2晶體中含有陰陽離子總數為0.3NA | |
| D. | 1mol硫粉與足量的Cu粉共熱,轉移的電子數為2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com