
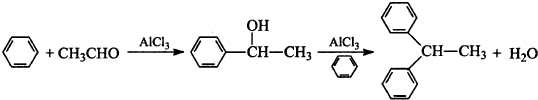
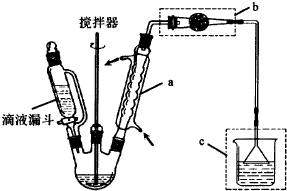
分析 (1)a儀器名稱是球形冷凝管(或冷凝管或冷凝器);產物中含有水,氯化鋁屬于強酸弱堿鹽,易水解;
氯化鋁水解生成HCl,HCl有刺激性氣味,不能直接排空,且極易溶于水;
(2)氯化鋁易水解生成氫氧化鋁,干燥管中物質吸收水蒸氣防止氯化鋁水解;
(3)第二次水洗目的是洗去可溶性無機物;無水硫酸鎂具有吸水性;
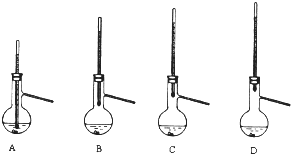
(4)蒸餾時溫度計測量餾分溫度;溫度計位置越高,得到餾分溫度越高;
(5)根據原料和轉化關系可先計算出1,1-二苯乙烷的理論產量,再根據產率=$\frac{實際產量}{理論產量}$×100%計算1,1-二苯乙烷產率;
解答 解:(1)a儀器名稱是球形冷凝管(或冷凝管或冷凝器);氯化鋁屬于強酸弱堿鹽,易水解,產物中含有水,所以氯化鋁水解生成氫氧化鋁和HCl,水解方程式為AlCl3+3H2O?Al(OH)3+3HCl;
氯化鋁水解生成HCl,HCl有刺激性氣味,不能直接排空,且極易溶于水,所以用水吸收生成的HCl,為防止倒吸,尾氣處理裝置連接倒置漏斗,
故答案為:球形冷凝管(或冷凝管或冷凝器);AlCl3+3H2O?Al(OH)3+3HCl;吸收HCl氣體;
(2)尾氣處理裝置中用水作吸收劑,氯化鋁易水解生成氫氧化鋁,為防止燒杯中的水蒸氣進入反應裝置中,所以用干燥管中物質吸收水蒸氣,
故答案為:防止燒杯中的水蒸氣進入反應器中與三氯化鋁反應;
(3)第二次水洗目的是洗去可溶性無機物,如氯化鋁、鹽酸和碳酸鈉;
無水硫酸鎂具有吸水性,能作干燥劑,所以無水硫酸鎂的作用是作干燥劑,
故答案為:洗掉氯化鋁、鹽酸和碳酸鈉(或洗掉可溶性無機物);干燥;
(4)蒸餾時溫度計測量餾分溫度,所以溫度計水銀球位于燒瓶支管口處;溫度計位置越高,得到餾分溫度越高,可能會導致收集到的產品中混有低沸點雜質的裝置是AB,故答案為:C;AB.
(5)根據題中條件可知,苯的物質的量為$\frac{140×0.88}{78}$mol=1.58mol,乙醛的物質的量為$\frac{5.5}{44}$mol=0.125mol,根據物質轉化關系,苯過量,所以1,1-二苯乙烷的理論產量為0.125×(77+77+28)g=22.75,所以1,1-二苯乙烷的產率=$\frac{實際產量}{理論產量}$×100%=$\frac{12.5g}{22.75g}$×100%=55%,
故選C;
點評 本題考查制備實驗方案設計,側重考查學生分析、基本操作等能力,明確實驗原理是解本題關鍵,知道每個儀器作用、物質的性質,學生對于制備實驗較陌生,對于有機物性質較陌生,從而導致得分率較低,為學習難點.


 倍速訓練法直通中考考點系列答案
倍速訓練法直通中考考點系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作業本系列答案
名校作業本系列答案 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用CuSO4溶液將ZnS轉化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液與過量NaOH溶液混合加熱:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性電極電解飽和的KCl溶液:2H++2Cl$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | X | Y | Z | W |
| 原子半徑/pm | 160 | 143 | 70 | 66 |
| 主要化合價 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金屬性X<Y | |
| B. | 一定條件下,Z單質與W的常見單質直接生成ZW2 | |
| C. | Y的最高價氧化物對應的水化物能溶于稀氨水 | |
| D. | 一定條件下,W單質可以和Z單質在放電條件下發生化合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 改進汽車尾氣凈化技術,減少大氣污染物的排放 | |
| B. | 開發利用可再生能源,減少化石燃料的使用 | |
| C. | 過度開采礦物資源,促進地方經濟發展 | |
| D. | 研發可降解高分子材料,減少“白色污染” |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,化合物ABF的電子式為
,化合物ABF的電子式為 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 都是常用調味品的主要成分 | B. | 都能使紫色石蕊溶液褪色 | ||
| C. | 都能和CaCO3反應 | D. | 都能發生酯化反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com