
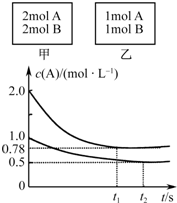
 向甲、乙兩個容積均為1L的恒容容器中,分別充入2mol A、2mol B和1mol A、1mol B.相同溫度下,發生反應:A(g)+B(g)?xC(g);△H<0.測得兩容器中c(A)隨時間t的變化如圖所示.下列說法正確的是( )
向甲、乙兩個容積均為1L的恒容容器中,分別充入2mol A、2mol B和1mol A、1mol B.相同溫度下,發生反應:A(g)+B(g)?xC(g);△H<0.測得兩容器中c(A)隨時間t的變化如圖所示.下列說法正確的是( )| A. | 甲、乙兩容器中反應達平衡時,平衡常數K(甲)<K(乙) | |
| B. | x不可能等于2 | |
| C. | 將乙容器升溫可使甲、乙容器內各物質的體積分數相同 | |
| D. | 若向甲容器中再充入2mol A、2mol B,則平衡時甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 |
分析 由圖象可知平衡時,甲容器平衡時,A的轉化率為$\frac{2mol-0.78mol}{2mol}$=61%,乙容器內A的轉化率為$\frac{0.5mol}{1mol}$=50%,甲容器內壓強比乙容器內大,增大壓強向正反應移動,增大壓強平衡壓強增大向著體積減小的方向移動,故:1+1>X,所以x=1.
A、相同溫度下A(g)+B(g)?xC(g),化學平衡常數相同;
B、由圖象可知平衡時,甲容器平衡時,A的轉化率為$\frac{2mol-0.78mol}{2mol}$=61%,乙容器內A的轉化率為$\frac{0.5mol}{1mol}$=50%,甲容器內壓強比乙容器內大,增大壓強向正反應移動.若x=2,反應前后氣體體積不變,增大壓強不動;
C、乙容器單獨升溫,平衡向逆反應進行,乙容器內A的轉化率減小;
D、向甲容器中再充入2molA、2molB,可以等效為原平衡狀態下壓強增大一倍,平衡向正反應方向移動,A轉化率增大,平衡移動目的是降低濃度增大趨勢,但不能消除濃度增大,達新平衡時濃度比原平衡大.
解答 解:由圖象可知平衡時,甲容器平衡時,A的轉化率為$\frac{2mol-0.78mol}{2mol}$=61%,乙容器內A的轉化率為$\frac{0.5mol}{1mol}$=50%,甲容器內壓強比乙容器內大,增大壓強向正反應移動,增大壓強平衡壓強增大向著體積減小的方向移動,故:1+1>X,所以x=1.
A、甲、乙兩容器中反應是相同溫度下達平衡狀態,平衡常數K(甲)=K(乙),故A錯誤;
B、由上述分析可知x=1,若x=2,反應前后氣體體積不變,甲、乙為等效平衡,轉化率相等,平衡不變,不符合圖象中壓強變化,所以x不可能等于2,故B正確;
C、該反應為放熱反應,將乙容器單獨升溫,平衡向吸熱反應方向移動,即向逆反應方向移動,A的轉化率比甲容器的轉化率低,不可能使乙容器內各物質的體積分數與甲容器內的相同,故C錯誤;
D、向甲容器中再充入2molA、2molB,可以等效為原平衡狀態下壓強增大一倍,平衡向正反應方向移動,A轉化率增大,所以平衡時甲容器中c(A)小于2倍原平衡中的c(A),平衡移動目的是降低濃度增大趨勢,但不能消除濃度增大,達新平衡時濃度比原平衡大,所以平衡時甲容器中0.78mol/L<c(A)<1.56mol/L,故D正確.
故選BD.
點評 本題考查平衡圖象、等效平衡、外界條件對平衡影響、平衡計算等,難度中等,根據圖象計算平衡時轉化率,確定x值是解題的關鍵,注意B選項中壓強影響平衡移動的本質是改變體積進而影響反應混合物各組分的濃度,若反應混合物難度不發生變化,平衡不移動.是易錯點.


科目:高中化學 來源: 題型:選擇題

| A. | 負極反應為:Cu-2e-═Cu2+ | |
| B. | 若該原電池工作前兩電極質量相等,則工作后,當銅的質量減少6.4g時,兩電極質量相差21.6g(假設電解質溶液都是足量的) | |
| C. | 當銅的質量減小12.8 g時,外電路中通過0.4mol電子 | |
| D. | 原電池的總反應式為:Cu+2AgNO3═2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F 六種有機物.A能夠在光照條件下與氯氣發生取代反應,其二氯取代物有兩種; B與溴的四氯化碳溶液可以發生加成反應,加成產物是D,且D只有一種同分異構體E;C在FeBr3 的作用下,可以與液溴發生取代反應,取代產物是F,F沒有含苯環的同分異構體.根據以上事實,回答下列問題:
A、B、C、D、E、F 六種有機物.A能夠在光照條件下與氯氣發生取代反應,其二氯取代物有兩種; B與溴的四氯化碳溶液可以發生加成反應,加成產物是D,且D只有一種同分異構體E;C在FeBr3 的作用下,可以與液溴發生取代反應,取代產物是F,F沒有含苯環的同分異構體.根據以上事實,回答下列問題: ;
;查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗步驟 | 實驗結論 |
| ①氯水+1mL CCl4,振蕩,靜置,觀察四氯化碳層顏色 | 氧化性從強到弱的順序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振蕩,靜置,觀察四氯化碳層顏色 | |
| ③KI溶液+氯水+1mL CCl4,振蕩,靜置,觀察四氯化碳層顏色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com