
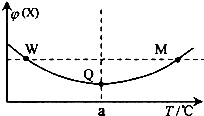
 在某2L恒容密閉容器中充入2mol X(g)和1mol Y(g)發生反應:2X(g)+Y(g)═3Z(g)△H,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如右圖所示.下列推斷正確的是( )
在某2L恒容密閉容器中充入2mol X(g)和1mol Y(g)發生反應:2X(g)+Y(g)═3Z(g)△H,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如右圖所示.下列推斷正確的是( )| A. | M點時,Y的轉化率最大 | |
| B. | 升高溫度,平衡常數減小 | |
| C. | 平衡后充入Z達到新平衡時Z的體積分數增大 | |
| D. | W,M兩點Y的正反應速率相等 |
分析 溫度在a℃之前,升高溫度,X的含量減小,溫度在a℃之后,升高溫度,X的含量增大,曲線上最低點為平衡點,最低點之前未達平衡,反應向正反應進行,最低點之后,各點為平衡點,升高溫度X的含量增大,平衡向逆反應方向移動,故正反應為放熱反應,據此分析解答.
解答 解:溫度在a℃之前,升高溫度,X的含量減小,溫度在a℃之后,升高溫度,X的含量增大,曲線上最低點為平衡點,最低點之前未達平衡,反應向正反應進行,最低點之后,各點為平衡點,升高溫度X的含量增大,平衡向逆反應方向移動,故正反應為放熱反應,
A.曲線上最低點Q為平衡點,升高溫度平衡向逆反應移動,Y的轉化率減小,所以Q點時,Y的轉化率最大,故A錯誤;
B.已知該反應為放熱反應,升高溫度,平衡逆移,平衡常數減小,故B正確;
C.反應前后氣體的物質的量不變,平衡時充入Z,達到平衡時與原平衡是等效平衡,所以達到新平衡時Z的體積分數不變,故C錯誤;
D.W點對應的溫度低于M點對應的溫度,溫度越高,反應速率越高,所以W點Y的正反應速率小于M點Y的正反應速率,故D錯誤;
故選B.
點評 本題考查化學平衡圖象、化學反應速率和平衡的影響因素、化學平衡常數等,難度中等,判斷最低點及之后各點為平衡點是解題的關鍵.


科目:高中化學 來源: 題型:解答題
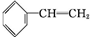 +Br2
+Br2
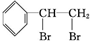 .
.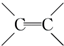 $\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$
$\stackrel{稀,冷KMnO_{4},溶液/OH-}{→}$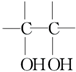 .請寫出A與稀、冷的KMnO4溶液在堿性條件下反應的化學方程式
.請寫出A與稀、冷的KMnO4溶液在堿性條件下反應的化學方程式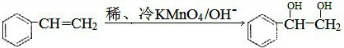 .
. .
.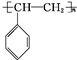 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 一定溫度范圍內用氯化鈉熔浸鉀長石(主要成份為KAlSi3O8)可制得氯化鉀,主要反應是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.
一定溫度范圍內用氯化鈉熔浸鉀長石(主要成份為KAlSi3O8)可制得氯化鉀,主要反應是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s)+Q.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈紅色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 與鋁反應產生大量氫氣的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 土壤中離子的吸附和交換過程,有保肥作用 | |
| B. | 由腎功能衰竭等疾病引起的血液中毒,可利用血液透析進行治療 | |
| C. | 水泥廠和冶金廠常用高壓直流電除去大量煙塵,減少對空氣的污染 | |
| D. | 臭氧、Cl2均可用于水的消毒凈化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由SO2通入Ba(NO3)2溶液產生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 電解精煉銅,電解結束后電解質溶液濃度不變 | |
| C. | 海水中Na+、Cl一結晶成NaCl的過程,形成了化學鍵 | |
| D. | 任何可逆反應,其平衡常數越大,反應速率、反應物的轉化率就越大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 操作 | 現象 | 結論 |
| A | 向鹽酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3難溶于酸 |
| B | 向等濃度的KCl、Kl混合液中滴加AgNO3溶液 | 先出現白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷與NaOH水溶液共熱后,加HNO3酸化,滴加AgNO3溶液 | 出現淡黃色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加過量的鹽酸 | 產生無色氣體 | Na2O2沒有變質 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 第6min后,生成A的平均速率為0mol/(L•min) | |
| B. | A的平衡轉化率為85% | |
| C. | 升高溫度時,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低溫度時,生成A的平均速率和消耗A的平均速率以不同倍數減少 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com