
 的空間構型為 ,與其互為等電子體的一種分子為 。
的空間構型為 ,與其互為等電子體的一種分子為 。 
| A.離子鍵 | B.σ鍵 | C.π鍵 | D.氫鍵 E.配位鍵 F.金屬鍵 G.極性鍵 |
 =1;(5)金剛石中一個碳原子與四個碳原子相連,Ga、As最外層電子數分別為3、5,Ga、As形成三個σ鍵,Ga還差2個電子達到8電子穩定結構,As有一對孤對電子,兩者之間形成配位鍵
=1;(5)金剛石中一個碳原子與四個碳原子相連,Ga、As最外層電子數分別為3、5,Ga、As形成三個σ鍵,Ga還差2個電子達到8電子穩定結構,As有一對孤對電子,兩者之間形成配位鍵

 課時訓練江蘇人民出版社系列答案
課時訓練江蘇人民出版社系列答案 黃岡經典趣味課堂系列答案
黃岡經典趣味課堂系列答案 啟東小題作業本系列答案
啟東小題作業本系列答案科目:高中化學 來源:不詳 題型:填空題
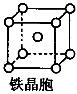
 3Na2O+2Fe+9N2↑。
3Na2O+2Fe+9N2↑。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.相同類型的離子晶體,晶格能越大,形成的晶體越穩定 |
| B.手性催化劑只催化或者主要催化一種手性分子的合成 |
| C.用金屬的電子氣理論能合理地解釋金屬易腐蝕的原因 |
| D.H3O+、NH4Cl和[Ag(NH3)2]+中均存在配位鍵 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題


查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 鍵和1個大
鍵和1個大 鍵,C6H6是非極性分子
鍵,C6H6是非極性分子| 元 素 | Mn | Fe | |
| 電離能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.依據元素的原子序數,推斷該元素原子的核外電子數 |
| B.依據原子最外層電子數的多少,推斷元素金屬性、非金屬性的強弱 |
| C.依據氣體的摩爾質量,推斷相同狀態下不同氣體密度的大小 |
| D.依據液體物質的沸點,推斷將兩種互溶液態混合物用蒸餾法分離的可行性 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
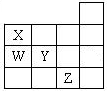
| A.與氫原子形成的化學鍵的鍵能:W比Y的大 |
| B.與氫原子形成的化學鍵的極性:X比Y的弱 |
| C.最低價氣態氫化物的沸點:X的比W的高 |
| D.XZ3的晶體屬于離子晶體 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com