
【題目】如圖所示2套實驗裝置,分別回答下列問題。

(1)裝置1為鐵的吸氧腐蝕實驗。一段時間后,取玻璃筒內的溶液滴入鐵氰化鉀溶液,可觀察到藍色沉淀,表明鐵被__________(填“氧化“或“還原”);向插入碳棒的玻璃筒內滴入酚酞溶液,可觀察到碳棒附近的溶液變紅,該電極反應為______________________。
(2)裝置2中甲燒杯盛放100 mL 0.2 mol/L的NaCl溶液,乙燒杯盛放100 mL 0.5mol/L的CuSO4溶液。反應一段時間后,停止通電。向甲燒杯中滴入幾滴酚酞,觀察到石墨電極附近首先變紅。
①電源的M端為__________極;甲燒杯中Cu電極的電極反應為__________。
②乙燒杯中電解反應的離子方程式為______________________________。
③取出乙溶液中Cu電極,洗滌、干燥、稱量、電極增重0.64 g,甲燒杯中石墨電極產生的氣體標準狀況下體積為__________mL。若想使乙燒杯中電解質溶液復原,可以加入的物質是:__________(填字母)。(Cu的原子量為64)
A. CuO B. Cu(OH)2 C. Cu2(OH)2CO3 D. CuCO3 E. CuSO4
【答案】氧化 O2+4e-+2H2O==4OH- 正 Cu-2e-==Cu2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 224 AD
2Cu+O2↑+4H+ 224 AD
【解析】
(1)裝置1為鐵的吸氧腐蝕實驗,發生電化學腐蝕,鐵釘附近的溶液有藍色沉淀,表明鐵被氧化,鐵為負極,電極反應式為O2+4e-+2H2O═4OH-;
(2)①M端為正極,N端為負極,陰極反應為Cu-2e-═Cu2+;
②電解的離子方程式為2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③根據電極反應和電極上轉移電子的數目相等進行計算。
(1)裝置1為鐵的吸氧腐蝕實驗,發生電化學腐蝕,鐵釘附近的溶液有藍色沉淀,表明鐵被氧化,鐵為負極,碳為正極,觀察到碳棒附近的溶液變紅,說明在碳極上氧氣得電子生成OH-離子,反應的電極反應式為O2+4e-+2H2O═4OH-,故答案為:氧化,O2+4e-+2H2O═4OH-。
(2)①反應一段時間后,停止通電.向甲燒杯中滴入幾滴酚酞,觀察到石墨電極附近首先變紅,說明在石墨電極上生成OH-離子,電極反應為:2H2O+2e-═2OH-+H2↑,發生還原反應,為電解池的陰極,連接電源的負極,即M端為正極,N端為負極,陰極反應為Cu-2e-═Cu2+,故答案為:正;Cu-2e-═Cu2+。
②乙燒杯電解硫酸銅溶液,石墨為陽極,電極反應為4OH--4e-═O2↑+H2O,Cu為陰極,電極反應為Cu2++2e-═Cu,電解的總反應為2Cu2++2H2O![]() 2Cu+O2↑+4H+,
2Cu+O2↑+4H+,
故答案為:2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③取出Cu電極,洗滌、干燥、稱量、電極增重0.64g,則生成Cu的物質的量為0.64g/64g/mol=0.01mol,轉移的電子的物質的量為0.01mol×2=0.02mol,根據甲燒杯產生氣體的電極反應計算生成氣體的體積,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=22.4L×0.02mol/2mol=0.224L,即224ml。
由電解總反應方程式為2CuSO4+2H2O![]() 2Cu+O2↑+4H2SO4,根據析出什么加入什么的原則,則應往溶液中加入CuO或CuCO3,故AD正確。
2Cu+O2↑+4H2SO4,根據析出什么加入什么的原則,則應往溶液中加入CuO或CuCO3,故AD正確。
故答案為:224,AD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】實驗室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根據這兩種溶液的配制情況回答下列問題:
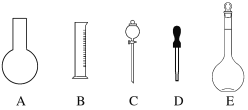
(1)①如圖所示的儀器中配制溶液肯定不需要的是____________________(填字母),
②配制上述溶液還需用到的玻璃儀器是__________________(填儀器名稱)。
③下列有關容量瓶使用說法不正確的是( )
a.容量瓶使用前一定要檢查是否漏液。其操作為裝水蓋上瓶塞→倒立觀察是否漏夜→正立→玻璃塞旋轉180°→再倒立觀察是否漏夜。
b.不能作為反應容器或長期貯存溶液的容器;但是可以配制任意體積的溶液。
c.不能將固體或濃溶液直接在容量瓶中溶解或稀釋;不能加入過冷或過熱的液體 。
d.用容量瓶配制溶液,定容時俯視刻度線,所配溶液濃度偏小。
(2)在配制NaOH溶液時:
①根據計算用托盤天平稱取NaOH的質量為________g;
②若NaOH溶液在轉移至容量瓶時,灑落了少許,則所得溶液濃度___________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固體溶解后立即移入容量瓶→洗滌燒杯和玻璃棒→洗滌液移入容量瓶→定容,則所得溶液濃度___________(填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液時:
①所需質量分數為98%、密度為1.84 g·cm-3的濃硫酸的體積為__________(計算結果保留一位小數)mL;
②如果實驗室有15 mL、50 mL、100 mL量筒,應選用___________mL量筒最好;
③配制過程中需先在燒杯中將濃硫酸進行稀釋,稀釋時操作方法是__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某物質為易溶于水的白色粉末,在工業循環水中可用作殺菌劑,也可用作鈣、鎂離子的絡合劑,其結構可用下圖表示。已知四種常見元素X、Y、Z、W原子序數依次增大,且分別位于不同周期,下列說法錯誤的是( )

A.Z元素在該物質中為+3價
B.W的簡單陽離子比Z的簡單陰離子多一個電子層
C.W的最高價氧化物的水化物的水溶液可與Al粉發生反應
D.Z單質與Y單質反應可產生Z2Y5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前我國主要采用硫酸法生產鈦白(TiO2),每年產生至少100萬噸鈦白廢液,其中含H2SO4約20%,還有少量Fe2+、TiO2+、Al3+。利用鈦白廢液浸出氧化鋅生產七水硫酸鋅,具有原料易得、工藝簡單、回收率高和產品純度高等優點。生產流程簡化如下:

回答下列問題:
(1)“浸出”時發生的主要反應的離子方程式為_______。
(2)為尋找“浸出”的最佳條件,做9組對比實驗得下表:
因素 | 溫度/℃ | 反應時間/h | 固液比 | 產率/% |
1 | 70 | 2 | 1∶6.5 | 79.83 |
2 | 70 | 3 | 1∶7.5 | 86.18 |
3 | 70 | 4 | 1∶8.5 | 84.33 |
4 | 80 | 2 | 1∶7.5 | 83.06 |
5 | 80 | 3 | 1∶8.5 | 87.02 |
6 | 80 | 4 | 1∶6.5 | 95.38 |
7 | 90 | 2 | 1∶8.5 | 83.58 |
8 | 90 | 3 | 1∶6.5 | 88.95 |
9 | 90 | 4 | 1∶7.5 | 89.64 |
由表中數據可知,“浸出率”最高時的反應條件是_______。
(3)從生產實際考慮,調濾液的pH時選擇加入石灰乳的原因是_______。
(4)常溫下,按1:6固液質量比反應的浸出液中鋅離子濃度最大值約為2.5mol/L,若Ksp[Zn(OH)2]=1.2×10-17,lg4.8≈0.68。則加入石灰乳調節的pH應不超過______(保留一位小數)。
(5)在加熱下鼔入空氣時,發生反應的化學方程式是___,此時TiO2+也會水解生成H2TiO3沉淀,發生反應的離子方程式為_____。
(6)加熱下加入H2O2目的是進一步氧化除雜,氧化產物為__。抽濾得到的濾渣主要成分有___和H2TiO3(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國科研人員采用新型錳催化體系,選擇性實現了簡單酮與亞胺的芳環惰性C-H的活化反應。利用該反應制備化合物J的合成路線如下:

已知:
回答下列問題:
(1)A中官能團的名稱是______。F的化學名稱是______。
(2)C和D生成E的化學方程式為_____________。
(3)G的結構簡式為________。
(4)由D生成F,E和H生成J的反應類型分別是______、_____。
(5)芳香化合物K是E的同分異構體。若K能發生銀鏡反應,則K可能的結構有____種,其中核磁共振氫譜有四組峰的結構簡式為______(任寫一種)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向0.1mol·L-1NaA溶液中逐滴滴加鹽酸,測得混合溶液的pH與p![]() 變化關系如圖所示[
變化關系如圖所示[![]() =-lg
=-lg![]() ]。下列說法正確的是
]。下列說法正確的是

A. a點溶液中c(Na+)=c(A-)
B. 電離常數K(HA)的數量級為10-4
C. 滴加過程中![]() 不斷減小
不斷減小
D. b點溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用酸解法制鈦白粉產生的廢液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生產鐵紅和補血劑乳酸亞鐵的工藝流程如圖所示:

已知:TiOSO4可溶于水,在水中可以電離為TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀為可逆反應;乳酸結構簡式為CH3CH(OH)COOH。
回答下列問題:
(1)TiOSO4中鈦元素的化合價是____________,步驟①中分離硫酸亞鐵溶液和濾渣的操作是___________。
(2)濾渣的主要成分為TiO2·xH2O,結合離子方程式解釋得到濾渣的原因:________。
(3)從硫酸亞鐵溶液中得到硫酸亞鐵晶體的操作方法是____________________;硫酸亞鐵在空氣中煅燒生成鐵紅和三氧化硫,該反應的氧化劑和還原劑的物質的量之比為______。
(4)步驟④中發生反應的離子方程式為______________________。
(5)步驟⑥必須控制一定的真空度,原因是有利于蒸發水以及____________________。
(6)實驗室中檢驗溶液B中主要陽離子的方法是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y和Z三種元素的原子序數之和等于42。X元素原子的4p軌道上有3個未成對電子,Y元素原子的最外層2p軌道上有2個未成對電子。X跟Y可形成化合物X2Y3,Z元素可以形成負一價離子。請回答下列問題:
(1)X元素原子基態時的電子排布式為__________,該元素的符號是__________;
 (2)Y元素原子的價層電子的軌道表示式為________,該元素的名稱是__________;
(2)Y元素原子的價層電子的軌道表示式為________,該元素的名稱是__________;
(3)X與Z可形成化合物XZ3,該化合物的空間構型為____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金屬鋅還原為XZ3,產物還有ZnSO4和H2O,該反應的化學方程式是_________________________________________________;
(5)比較X的氫化物與同族第二、第三周期元素所形成的氫化物穩定性、沸點高低并說明理由____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸亞鐵晶體{[CH3CH(OH)COO]2Fe·3H2O,相對分子質量為288}易溶于水,是一種很好的補鐵劑,可由乳酸[CH3 CH(OH)COOH]與FeCO3反應制得。
I.碳酸亞鐵的制備(裝置如下圖所示)

(1)儀器B的名稱是____;實驗操作如下:打開kl、k2,加入適量稀硫酸,關閉kl,使反應進行一段時間,其目的是____。
(2)接下來要使儀器C中的制備反應發生,需要進行的操作是____,其反應的離子方程式為____。
(3)儀器C中混合物經過濾、洗滌得到FeCO3沉淀,檢驗其是否洗凈的方法是____。
Ⅱ.乳酸亞鐵的制各及鐵元素含量測定
(4)向純凈FeCO3固體中加入足量乳酸溶液,在75℃下攪拌使之充分反應,經過濾,在____的條件下,經低溫蒸發等操作后,獲得乳酸亞鐵晶體。
(5)兩位同學分別用不同的方案進行鐵元素含量測定:
①甲同學通過KMnO4滴定法測定樣品中Fe2+的含量計算樣品純度。在操作均正確的前提下,所得純度總是大于l00%,其原因可能是 ___。
②乙同學經查閱資料后改用碘量法測定鐵元素的含量計算樣品純度。稱取3.000g樣品,灼燒完全灰化,加足量鹽酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL該溶液加入過量KI溶液充分反應,然后加入幾滴淀粉溶液,用0. 100 mol·L-1硫代硫酸鈉溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),當溶液____,即為滴定終點;平行滴定3次,硫代硫酸鈉溶液的平均用量為24. 80 mL,則樣品純度為____%(保留1位小數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com