
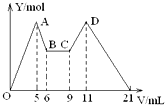
 向MgCl2、AlCl3的混合溶液開始滴加6mol/L的試劑A,之后改滴試劑B,所得沉淀物質的量Y(mol)與試劑體積V(mL)間的關系如圖所示.以下結論不正確的是( )
向MgCl2、AlCl3的混合溶液開始滴加6mol/L的試劑A,之后改滴試劑B,所得沉淀物質的量Y(mol)與試劑體積V(mL)間的關系如圖所示.以下結論不正確的是( )| A. | 從6到9,相應離子反應方程式為H++OH-=H2O | |
| B. | A 是NaOH,B是鹽酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是鹽酸,B是NaOH,且c(NaOH)=2c (HCl) |
分析 根據圖象可知先加入的試劑A一開始就產生沉淀,而隨試劑的加入沉淀部分溶解,所以試劑A為NaOH,后來加入的試劑B沉淀的量不變是鹽酸與過量的堿反應,繼續加試劑B,沉淀的是增加是偏鋁酸鹽與酸反應生成沉淀氫氧化鋁,當偏鋁酸鹽全部轉化為氫氧化鋁,再滴入酸,又溶解了氫氧化鋁和氫氧化鎂,所以試劑B為鹽酸,
A、6-9mL之間沉淀量沒有發生改變說明鹽酸在中和過量的NaOH;
B、根據AB段用了1mL,CD段用了2mL,可知NaOH的濃度是鹽酸濃度的2倍;
C、根據AB段用了1mL,OA段用了5mL可知原混合溶液中c(Al3+):c(Mg2+)=1:1,結合電荷守恒分析c(Al3+):c(Mg2+):c(Cl-)的值;
D、試劑A為NaOH,后加入的試劑B為鹽酸.
解答 解:A、在6mL處由原來的滴加NaOH,改為滴加鹽酸,由圖象知6mL~9mL時對應液體中沉淀量不變,可以推知此時僅僅發生酸堿中和反應,即H++OH-=H2O,故A正確;
B、根據加入前6mL試劑時,先有沉淀生成而后溶解,所以,試劑A是NaOH,則B是鹽酸;又由圖可知,5→6(1mL)為Al(OH)3的溶解,發生反應:Al(OH)3↓+NaOH=NaAlO2+2H2O,9→11(2 mL)為AlO2-恰好完全生成Al(OH)3沉淀:發生反應:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,根據鋁元素守恒知:
NaOH~Al(OH)3~AlO2-~H+
1 1 1 1
由此可以推出:n(NaOH)=n(HCl)又因為v(NaOH):v(HCl)=1:2,所以:c(NaOH):c(HCl)=2:1,故B正確;
C、設氫氧化鈉的濃度為6mol/l,從加入5mLA生成沉淀最多,再繼續加1mLA沉淀量減少到最小值,滴加氫氧化鈉在5→6(1 mL)時相應反應的離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n[Al(OH)3]=(1×6×10-3)mol;由前5mLNaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3)mol,溶液中陰陽離子所帶電荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故C正確;
D、試劑A為NaOH,后加入的試劑B為鹽酸,由B可知,c(NaOH)=2c (HCl),故D錯誤;
故選D.
點評 本題考查了鎂、鋁重要化合物的性質,題目難度較大,能正確分析圖象中轉折線發生的化學反應是解本題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 自來水 | B. | 0.5 mol•L-1鹽酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由反應①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反應①②轉移的電子數相同 | |
| C. | 0.2 mol CH4還原NO2至N2,放出的熱量為173.4 kJ | |
| D. | 若用標準狀況下4.48 L CH4還原NO2至N2,整個過程中轉移的電子總數為1.60 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某學生用實驗室常見的酸、堿、鹽和金屬為反應物,并利用一個底部有小孔的試管和一個廣口瓶組裝成如圖所示的替代簡易氣體發生器的即開即停裝置,該裝置中裝有銅絲網隔板,利用該裝置可制取哪些氣體H2、CO2(答2種即可);若將銅絲網隔板改為鐵絲網隔板,則該裝置可用于制取何種氣體H2,寫出反應的離子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
某學生用實驗室常見的酸、堿、鹽和金屬為反應物,并利用一個底部有小孔的試管和一個廣口瓶組裝成如圖所示的替代簡易氣體發生器的即開即停裝置,該裝置中裝有銅絲網隔板,利用該裝置可制取哪些氣體H2、CO2(答2種即可);若將銅絲網隔板改為鐵絲網隔板,則該裝置可用于制取何種氣體H2,寫出反應的離子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自然界存在大量硅單質 | |
| B. | 自然界的硅易開采,且可再生 | |
| C. | 硅燃料便于運輸、貯存,從安全角度考慮,硅是優質燃料 | |
| D. | 硅燃料燃燒放出的熱量多,其燃燒產物對環境的污染容易有效地控制 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液、蒸餾、萃取 | B. | 萃取、蒸發、分液 | C. | 分液、萃取、蒸餾 | D. | 蒸餾、萃取、分液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (C)
(C) (D)
(D)
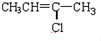 (G)
(G)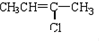 (H)
(H)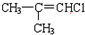
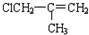 (J)
(J)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com