
分析 (1)設兩溶液體積都為VL,根據c=nV計算出硫酸鐵的物質的量,再根據硫酸鐵的化學式計算鐵離子的物質的量,最后根據c=$\frac{n}{V}$計算出混合液中鐵離子的物質的量濃度;
(2)2.0 mol/L H2SO4溶液中H+的物質的量濃度為4mol/L,根據稀釋定律,稀釋前后溶質的物質的量不變,據此計算混合后c(H+);
根據n=cV計算出硫酸鐵、硫酸的物質的量,再根據化學式計算出硫酸根離子的物質的量,最后根據c=$\frac{n}{V}$計算出混合液中SO42-的物質的量濃度;
(3)三價鐵離子氧化性強于氫離子,混合物中加入鐵,先與三價鐵離子反應,剩余鐵再與氫離子反應生成氫氣,依據方程式:Fe+2Fe3+=3Fe2+,
Fe+H2SO4=FeSO4+H2↑,計算解答.
解答 解:(1)設混合液體積為2VL,VL 2.0mol/L的硫酸鐵溶液中含有硫酸鐵的物質的量為:2.0mol/L×VL=2Vmol,2Vmol硫酸鐵中含有4Vmol鐵離子,混合液中鐵離子的濃度為:c(Fe3+)=$\frac{4Vmol}{2VL}$=2 mol/L,
答:混合液中Fe3+的物質的量濃度為2mol/L;
(2)2.0 mol/L H2SO4溶液中H+的物質的量濃度為4mol/L,根據稀釋定律,稀釋前后溶質的物質的量不變,則等體積混合后,溶液中H+的物質的量濃度c(H+)=$\frac{1}{2}$×4mol/L=2mol/L.
設混合液體積為2VL,2.0 mol/L H2SO4VL溶液中含有硫酸的物質的量為:2.0mol/L×VL=2Vmol,2Vmol硫酸能夠電離出2Vmol硫酸根離子,2Vmol硫酸鐵中含有6Vmol硫酸根離子,則混合液中硫酸根離子濃度為:c(SO42-)=$\frac{2Vmol+6Vmol}{2VL}$=4 mol/L,
答:混溶液中H+的物質的量濃度為2mol/L;SO42-的物質的量濃度為4mol/L;
(3)將2.0mol/LFe2(SO4)3溶液和2.0mol/LH2SO4等體積混合,混和后的溶液為2L,則含有三價鐵離子的物質的量為:2.0mol/L×2×1L=4mol,依據方程式:Fe+2Fe3+=3Fe2+,可知消耗鐵物質的量為2mol,剩余鐵與硫酸反應生成氫氣標準狀況下的體積為16.8L,物質的量為:$\frac{16.8L}{22.4L/mol}$=0.75mol,依據方程式:Fe+H2SO4=FeSO4+H2↑,可知消耗鐵物質的量為0.75mol,共消耗鐵物質的量為2mol+0.75mol=2.75mol,質量為:2.75mol×56g/mol=154g;
答:加入鐵粉的質量為154g.
點評 本題考查物質的量濃度的計算,涉及定義法、稀釋定律、電荷守恒、元素守恒等方法,難度中等,注意守恒思想的運用,注意氧化還原反應強弱規律的應用.


科目:高中化學 來源: 題型:解答題
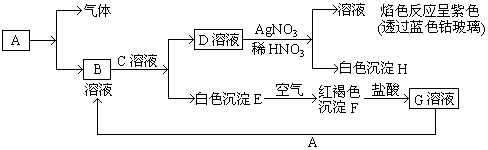
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2×10-7 mol/L | B. | 0.1×10-7 mol/L | C. | 0.5×10-7 mol/L | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使品紅溶液褪色 | B. | 能使石蕊試液先變紅再褪色 | ||
| C. | 能使酸性高錳酸鉀溶液褪色 | D. | 能使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
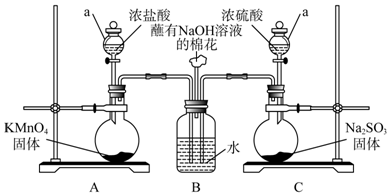
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
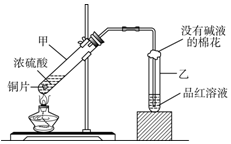 用如圖所示的裝置可以驗證濃硫酸與銅是否發生反應,并探討反應所產生氣體的性質.
用如圖所示的裝置可以驗證濃硫酸與銅是否發生反應,并探討反應所產生氣體的性質.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L0.1mol•L-1的NaHSO4溶液中HSO4-總數為0.1NA | |
| B. | 16g16O2和18g18O2中含有的質子數均為8NA | |
| C. | 1molFe與足量的稀硝酸反應,轉移電子數為2NA | |
| D. | 標準狀況下,2.24LCl2溶于水所得溶液中含有的氯離子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氫氧燃料電池是符合綠色化學理念的新型發電裝置.如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定.請回答:
氫氧燃料電池是符合綠色化學理念的新型發電裝置.如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定.請回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com