

 ;A→F
;A→F
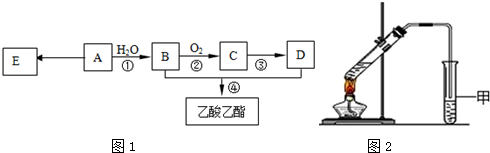
分析 A在濃硫酸存在下既能和乙醇反應,又能和乙酸反應,說明A中既有羧基又有羥基.A催化氧化的產物不能發生銀鏡反應,說明羥基不在碳鏈的端點上,可判斷A為CH3CH(OH)COOH,而A被氧化可得CH3COCHO,不能發生銀鏡反應,A與乙醇發生酯化反應生成B為CH3CH(OH)COOCH2CH3,A與乙酸發生酯化反應生成D為CH3COOCH(CH3)COOH,A在濃硫酸、加熱條件下生成E,E可以溴水褪色,應發生消去反應,則E為CH2=CHCOOH,A在濃硫酸、加熱條件下生成六原子環狀化合物F,結合F的分子式可知,為2分子A發生酯化反應生成環狀化合物,故F為 ,據此分析解答.
,據此分析解答.
解答 解:A在濃硫酸存在下既能和乙醇反應,又能和乙酸反應,說明A中既有羧基又有羥基.A催化氧化的產物不能發生銀鏡反應,說明羥基不在碳鏈的端點上,可判斷A為CH3CH(OH)COOH,而A被氧化可得CH3COCHO,不能發生銀鏡反應,A與乙醇發生酯化反應生成B為CH3CH(OH)COOCH2CH3,A與乙酸發生酯化反應生成D為CH3COOCH(CH3)COOH,A在濃硫酸、加熱條件下生成E,E可以溴水褪色,應發生消去反應,則E為CH2=CHCOOH,A在濃硫酸、加熱條件下生成六原子環狀化合物F,結合F的分子式可知,為2分子A發生酯化反應生成環狀化合物,故F為 ,
,
(1)由上述分析可知,A為CH3CH(OH)COOH,B為CH3CH(OH)COOCH2CH3,D為CH3COOCH(CH3)COOH,
故答案為:CH3CH(OH)COOH;CH3CH(OH)COOCH2CH3;CH3COOCH(CH3)COOH;
(2)A→E是乳酸在濃硫酸、加熱條件下發生消去反應生成CH2=CHCOOH,反應方程式為: ,該反應類型是消去反應;
,該反應類型是消去反應;
A→F是乳酸在濃硫酸、加熱條件下發生酯化反應生成環狀化合物 ,反應方程式為:
,反應方程式為: ,該反應是酯化反應或取代反應,
,該反應是酯化反應或取代反應,
故答案為: ;
; ;消去反應;酯化反應或取代反應.
;消去反應;酯化反應或取代反應.
點評 本題考查有機物推斷,為高頻考點,側重考查學生分析推斷能力,正確判斷A結構簡式是解本題關鍵,熟悉常見有機物官能團及其性質,題目難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
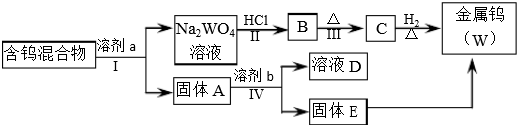
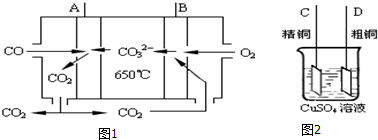
| 溶劑 | 煮沸時間(min) | W2O5(%) | WO3(%) | WO2 | 金屬鎢 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④飽和Na2C2O4 ⑤飽和Na2C2O4(在CO2氣氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未檢出 | 未檢出 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
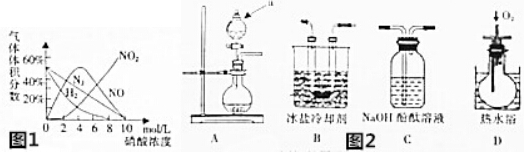
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 A~D是原子序數在20以內的元素,其性質或結構信息如下表
A~D是原子序數在20以內的元素,其性質或結構信息如下表| 元素 | A | B | C | D | E |
| 性質或 結構 信息 | 其原子核內只有1個質子 | 其單質在空氣中體積含量最多 | 地殼中含量最多的金屬元素 | 其單質和化合物的焰色反應均為黃色 | 單質在常溫、常壓下是黃綠色氣體 |
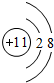 ,B原子的電子式:
,B原子的電子式: ,E離子的電子式:
,E離子的電子式: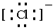 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
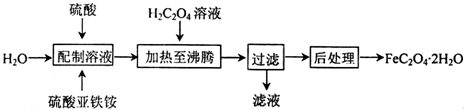

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 標準狀況下,1.12LCCl4含有Cl原子數目為0.4NA | |
| B. | 標準狀況下,2.24L氯氣中含有的電子總數為3.4mol | |
| C. | 常溫常壓下,4.4gCO2與N2O混合氣體中含有的原子總數為0.3NA | |
| D. | 39gNa2O2與足量H2O反應,轉移電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com