
| A. | 將40 g NaOH固體溶于1 L水中所得的溶液 | |
| B. | 將22.4 L HCl氣體溶于水配成1 L溶液 | |
| C. | 1 L含K+的物質的量為2 mol的K2SO4溶液 | |
| D. | 將100 mL 0.5 mol•L-1的NaNO3溶液加熱蒸發掉50 g水后所得的溶液 |
分析 A.體積指溶液體積等于溶劑體積;
B.根據溫度、壓強對氣體摩爾體積的影響分析判斷;
C.根據K2SO4的化學式知,溶液中c(K+)=2c(K2SO4),而c(K+)=$\frac{n}{V}$即可計算;
D.根據蒸發掉50g水后溶液體積不是50mL.
解答 解:A.體積指溶液體積不是溶劑體積,所以40gNaOH溶解于1L水中配成的NaOH溶液濃度不是1mol/L,故A錯誤;
B.氯化氫所處的狀態不一定是標準狀況,不能使用氣體摩爾體積22.4L/mol,體積一定,影響氣體的物質的量的因素有溫度、壓強,22.4LHCl氣體的物質的量不一定是1mol,故B錯誤;
C.1 L含K+的物質的量為2 mol的K2SO4溶液中,c(K+)=$\frac{2mol}{1L}$=2mol/L,故c(K2SO4)=2mol/L×$\frac{1}{2}$=1mol/L,故C正確;
D.加熱蒸發掉50g水后的溶液體積不是50mL,則溶液濃度不是1mol/L,故D錯誤;
故選C.
點評 本題考查了物質的量濃度的計算與判斷,題目難度中等,明確物質的量濃度的概念及計算方法為解答關鍵,試題培養了學生的分析能力及化學計算能力


科目:高中化學 來源: 題型:填空題


 .
. B、
B、 C、
C、 D、
D、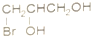
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | C-H | C-F | H-F | F-F |
| 鍵能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗項目 | 實驗現象 |
| FeCl3溶液中加入維生素C | 溶液褪色為淺綠色 |
| 飽和FeCl3溶液滴入沸水中 | 得到紅褐色液體 |
| 將銅銹放入鹽酸中 | 有無色氣泡產生 |
| A. | 維生素C具有還原性 | B. | FeCl3水解生成Fe(OH)3膠體 | ||
| C. | 銅銹與鹽酸反應有H2生成 | D. | 銅銹中含有碳酸根 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其化學鍵的類型為離子鍵、共價鍵.
,其化學鍵的類型為離子鍵、共價鍵.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋅是負極,氧化銀是正極 | |
| B. | 鋅發生還原反應,氧化銀發生氧化反應 | |
| C. | 溶液中OH-向正極移動,K+、H+向負極移動 | |
| D. | 隨著電極反應的不斷進行,電解質溶液的pH逐漸增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;取0.2mol/L的NaOH溶液與0.1mol/L的M溶液等體積混合,加熱至充分反應后,待恢復至室溫,剩余溶液中離子濃度由大到小的順序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此時測得溶液的pH=12,則此條件下M溶液中陰離子的電離平衡常數Ka=4×10?12(提示:若涉及多元弱酸的電離或多元弱酸根離子的水解,均只考慮第一步電離或水解)
;取0.2mol/L的NaOH溶液與0.1mol/L的M溶液等體積混合,加熱至充分反應后,待恢復至室溫,剩余溶液中離子濃度由大到小的順序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此時測得溶液的pH=12,則此條件下M溶液中陰離子的電離平衡常數Ka=4×10?12(提示:若涉及多元弱酸的電離或多元弱酸根離子的水解,均只考慮第一步電離或水解)查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com