
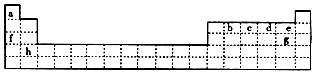
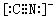 .
.分析 由元素在周期表中的位置可知a、b、c、d、e、f、g、h分別為H、C、N、O、F、Na、Cl、Ca,
(1)元素的非金屬越強,對應的氫化物越穩定;
(2)bc-為CN-,與氮氣為等電子體;
(3)發生2Na2O2+2CO2═2Na2CO3+O2、Na2CO3+2HCl═2NaCl+CO2↑+H2O、2Na2O2+4HCl═4NaCl+O2↑+2H2O,設Na2O2為xmol,Na2CO3為ymol,列方程式計算.
解答 解:由元素在周期表中的位置可知a、b、c、d、e、f、g、h分別為H、C、N、O、F、Na、Cl、Ca,
(1)非金屬性F>O>N,元素的非金屬越強,對應的氫化物越穩定,則為HF>H2O>NH3,故答案為:HF>H2O>NH3;
(2)bc-為CN-,與氮氣為等電子體,電子式為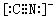 ,故答案為:
,故答案為: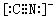 ;
;
(3)發生2Na2O2+2CO2═2Na2CO3+O2、Na2CO3+2HCl═2NaCl+CO2↑+H2O、2Na2O2+4HCl═4NaCl+O2↑+2H2O,設Na2O2為xmol,Na2CO3為ymol,
則$\left\{\begin{array}{l}{2x+2y=0.5}\\{\frac{1}{2}x+y=0.15}\end{array}\right.$,
x=0.2,y=0.05,
故答案為:Na2O2 0.2mol,Na2CO3 0.05mol.
點評 本題考查位置、結構與性質,為高頻考點,把握元素的位置、性質、元素周期律為解答的關鍵,側重分析與應用能力的考查,注意規律性知識的應用,題目難度不大.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:實驗題
| 溫度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
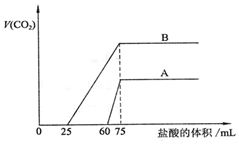 取等物質的量濃度的NaOH溶液兩份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分別將其稀釋為100mL,再分別向稀釋后的溶液中逐滴加入0.1mol/L的鹽酸,標準狀況下產生的CO2氣體體積與所加鹽酸體積之間的關系如圖所示,試回答下列問題:
取等物質的量濃度的NaOH溶液兩份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分別將其稀釋為100mL,再分別向稀釋后的溶液中逐滴加入0.1mol/L的鹽酸,標準狀況下產生的CO2氣體體積與所加鹽酸體積之間的關系如圖所示,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 圖乙中Y表示ⅡA元素的價電子數 | |
| B. | 圖丁中Y表示ⅦA元素氫化物的沸點 | |
| C. | 圖丙中Y表示第三周期元素的最高正化合價 | |
| D. | 圖甲中Y表示F-、Na+、Mg2+、Al3+四種離子的半徑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗事實 | 結論 |
| A | 其他條件相同,Na2S2O3溶液濃度越大,與同濃度的硫酸反應析出流沉淀所需的時間越短 | 當其他條件不變時,增大反應物濃度,化學反應速率增大 |
| B | 用銅作電極電解CuSO4溶液,CuSO4溶液濃度不變 | Cu2+沒有參與電極反應 |
| C | 在常溫下N2不能與O2反應,而白磷卻能自燃 | 氮元素的非金屬性比磷元素的弱 |
| D | 醋酸能與堿反應 | 醋酸分子一定不能存在于堿性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K3C60中既有離子鍵,又有極性鍵 | |
| B. | 該物質在熔融狀態下能導電 | |
| C. | 該物質的化學式寫成KC20 | |
| D. | 1mol K3C60中含有的離子鍵的數目為3NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | ||
| Z | W |
| A. | 元素的最高化合價Z大于Y | |
| B. | 元素的氣態氫化物的穩定性W強于Y | |
| C. | 原子半徑Z比Y小 | |
| D. | 元素的最高價氧化物的水化物酸性X大于W |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液 | B. | 澄清石灰水 | C. | 2 mol/L 鹽酸 | D. | 2 mol/L 硫酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com