
| A. | 100mL 3.0mol/L的鹽酸與5.6g鐵屑完全反應轉移的電子數為0.3NA | |
| B. | 含2mol H2SO4的濃硫酸與足量金屬銅完全反應,產生SO2的數目為NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中,陰陽離子總數為0.3NA | |
| D. | 16.0g的過氧(根)離子中含有的電子數為9NA |
分析 A、鹽酸與鐵屑發生反應生成氯化亞鐵;
B、稀硫酸與銅不反應;
C、從CO32-水解的角度分析;
D、根據n=$\frac{m}{M}$結合過氧根離子的結構分析.
解答 解:A、鹽酸與鐵屑發生反應生成氯化亞鐵,n(HCl)=0.3mol,n(Fe)=0.1mol,即鹽酸過量,要根據鐵的量來計算轉移電子的物質的量,由于鐵反應后變為+2價,故完全反應轉移的電子數為0.2NA,故A錯誤;
B、含2molH2SO4的濃硫酸與足量金屬銅完全反應,隨著反應的進行,硫酸濃度不斷減小,稀硫酸與銅不反應,則生成的SO2的數目小于NA,故B錯誤;
C、Na2CO3溶液中存在:CO32-+H2O HCO3-+OH-,則1L0.1mol/LNa2CO3溶液中,陰陽離子大于0.3NA,故C錯誤;
HCO3-+OH-,則1L0.1mol/LNa2CO3溶液中,陰陽離子大于0.3NA,故C錯誤;
D、n=$\frac{m}{M}$=$\frac{16g}{32g/mol}$=0.5mol,含電子的物質的量為0.5mol×(2×8+2)=9mol,所以含有的電子數為9NA,故D正確.
故選D.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的運用以及物質的狀態和結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 煤的干餾是物理變化 | |
| B. | 石油裂解的目的主要是為了得到更多的汽油 | |
| C. | 石油分餾能得到不同沸點范圍的產物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
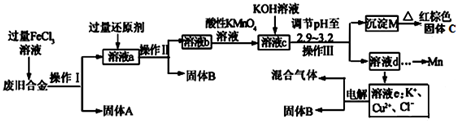
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將一定量氨氣通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物質的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀鹽酸至溶液呈中性時有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等濃度等體積的CH3COOH溶液和CH3COONa溶液混合均勻后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 僅含有Na+、H+、OH-、CH3COO-四種離子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液與0.1 mol•L-1NaOH溶液等體積混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液與0.2 mol•L-1NaOH溶液等體積混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、濃度均為0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2完全轉化為SO3 | |
| B. | 消耗2 mol SO2的同時生成2 mol SO3 | |
| C. | SO2、O2與SO3的物質的量之比為2:1:2 | |
| D. | SO2、O2與SO3的濃度不再隨時間變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 決定化學反應速率的主要因素是參加反應的物質的性質 | |
| B. | 催化劑可以使不起反應的物質發生反應 | |
| C. | 可以找到一種催化劑使水變成汽油 | |
| D. | 催化劑是決定化學反應速率的主要因素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
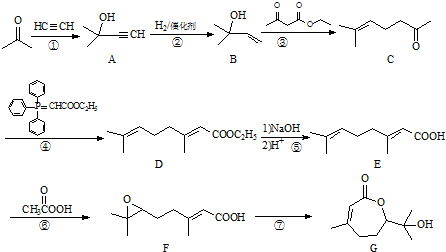
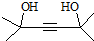 .
.
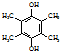
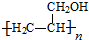 ,寫出合成流程圖(無機試劑任用).合成流程圖示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,寫出合成流程圖(無機試劑任用).合成流程圖示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com