
(14分) 用如右裝置來測(cè)定樣品中砷的含量。其中燒杯A中盛適量的1mol/L Na2SO4溶液,燒杯B中加攪拌器,以利于測(cè)定。E:直流穩(wěn)壓電源;K:開關(guān);R:可變電阻;G毫安計(jì);D:鹽橋。
用如右裝置來測(cè)定樣品中砷的含量。其中燒杯A中盛適量的1mol/L Na2SO4溶液,燒杯B中加攪拌器,以利于測(cè)定。E:直流穩(wěn)壓電源;K:開關(guān);R:可變電阻;G毫安計(jì);D:鹽橋。
1.稱取5.000g含砷樣品,溶解后加入還原劑將砷還原為三價(jià)砷As(Ⅲ)(HAsO32-),除去過量的還原劑后轉(zhuǎn)移到250mL容量瓶中配成250mL溶液。取40mL適當(dāng)濃度的KI和NaHCO3混合溶液加入B中,再用移液管取上述含砷溶液10mL加入B中,邊攪拌邊電解,電解產(chǎn)生的I2將As(Ⅲ)快速、定量的氧化為 As(V),以2mA的電流電解4分1秒后反應(yīng)完全,假定電能沒有損失。計(jì)算樣品中Aa2O3的百分含量。(1個(gè)電子的電量為1.602×10-19庫(kù)侖,As2O3的式量為197.84)
2.裝置A、B中的電解反應(yīng)只需2V以下的電壓就可實(shí)現(xiàn),為什么E要選擇40V以上?
3.反應(yīng)終點(diǎn)可用什么指示劑來確定?
4.HAsO32-的還原性與I-相比哪個(gè)強(qiáng)?電解時(shí)陽(yáng)極上生成I2而不生成As(V)的原因是什么?
5.HAsO32-可以和溶液中的O2反應(yīng),溶解氧將使測(cè)定結(jié)果偏高還是偏低?實(shí)驗(yàn)中怎樣用消除溶解氧的影響?
6.用指示劑判斷反應(yīng)終點(diǎn)有2秒的時(shí)間誤差不可避免,若要求測(cè)定結(jié)果的相對(duì)誤差不大于1%,則電解時(shí)間要設(shè)計(jì)控制為多少秒以上?
1.0.124%(5分)
2.隨著電解的進(jìn)行,電解池中電阻發(fā)生變化,為了得到穩(wěn)定的電解電流,采用較高的電壓和較大電阻,電流大小由E、R控制,I=E/(R+R電),R電相對(duì)較小,可忽略電阻。(2分)
3.淀粉(1分)
4.HAsO32-強(qiáng)(1分) 電極上I-的反應(yīng)速率比HAsO32-快(1分)
5.偏低(1分),先加過量的As(Ⅲ)攪拌反應(yīng),然后電解到淀粉剛好變色為止,再加待測(cè)液電解測(cè)定(2分)
6.若要求測(cè)定結(jié)果的相對(duì)誤差不大于1%,應(yīng)控制200秒以上。(2分)



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
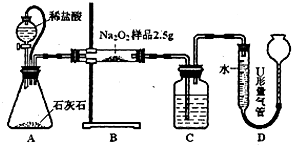 為測(cè)定含有Na2O雜質(zhì)的Na2O2樣品的純度,甲、乙二位同學(xué)設(shè)計(jì)了二種不同的實(shí)驗(yàn)方案.
為測(cè)定含有Na2O雜質(zhì)的Na2O2樣品的純度,甲、乙二位同學(xué)設(shè)計(jì)了二種不同的實(shí)驗(yàn)方案.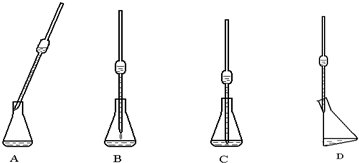
| 滴定次數(shù) | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗標(biāo)準(zhǔn)鹽酸的體積(mL) | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
(11分)為測(cè)定含有Na2O雜質(zhì)的Na2O2樣品的純度,甲、乙二位同學(xué)設(shè)計(jì)了二種不同的實(shí)驗(yàn)方案。
已知:2Na2O2+2CO2===2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
甲:用圖l所示裝置,通過測(cè)定Na2O2與CO2反應(yīng)生成O2的體積來測(cè)定樣品的純度。
(1)C中所盛的藥品是: 。
(2)A中橡皮管的作用是: 。
(3)利用該實(shí)驗(yàn)方案所測(cè)Na2O2的純度明顯偏大,其原因可能是 (填選項(xiàng)字母)。
a.裝置A、B中的空氣對(duì)測(cè)定結(jié)果產(chǎn)生了影響
b.裝置C中的空氣對(duì)測(cè)定結(jié)果產(chǎn)生了影響
c.讀數(shù)時(shí)U形量氣管中的液面左高右低
d.讀數(shù)時(shí)U形量氣管中的液面左低右高
乙:稱取3.500 g試樣,配成1000.00 mL溶液,用0.1000 mol·L-1的標(biāo)準(zhǔn)鹽酸滴定。
(4)取上述所配溶液25.00 mL于錐形瓶中,操作如下圖所示(手持部分省略):正確的操作是圖 ,取溶液所用儀器的名稱是 。

(5)滴定操作平行實(shí)驗(yàn)的數(shù)據(jù)記錄如下表:
| 滴定次數(shù) | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗標(biāo)準(zhǔn)鹽酸的體積(mL) | 24.98 | 25.00 | 25.02 |
由表中數(shù)據(jù)計(jì)算樣品中Na2O2純度為 。
查看答案和解析>>
科目:高中化學(xué) 來源:2010年寧波市八校高二下學(xué)期期末聯(lián)考化學(xué)試題 題型:實(shí)驗(yàn)題
(11分)為測(cè)定含有Na2O雜質(zhì)的Na2O2樣品的純度,甲、乙二位同學(xué)設(shè)計(jì)了二種不同的實(shí)驗(yàn)方案。
已知:2Na2O2+2CO2="==" 2Na2CO3+O2 2Na2O2+2H2O="==" 4NaOH+O2
甲:用圖l所示裝置,通過測(cè)定Na2O2與CO2反應(yīng)生成O2的體積來測(cè)定樣品的純度。
(1)C中所盛的藥品是: 。
(2)A中橡皮管的作用是: 。
(3)利用該實(shí)驗(yàn)方案所測(cè)Na2O2的純度明顯偏大,其原因可能是 (填選項(xiàng)字母)。
a.裝置A、B中的空氣對(duì)測(cè)定結(jié)果產(chǎn)生了影響
b.裝置C中的空氣對(duì)測(cè)定結(jié)果產(chǎn)生了影響
c.讀數(shù)時(shí)U形量氣管中的液面左高右低
d.讀數(shù)時(shí)U形量氣管中的液面左低右高
乙:稱取3.500 g試樣,配成1000.00 mL溶液,用0.1000 mol·L-1的標(biāo)準(zhǔn)鹽酸滴定。
(4)取上述所配溶液25.00 mL于錐形瓶中,操作如下圖所示(手持部分省略):正確的操作是圖 ,取溶液所用儀器的名稱是 。
(5)滴定操作平行實(shí)驗(yàn)的數(shù)據(jù)記錄如下表:
| 滴定次數(shù) | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗標(biāo)準(zhǔn)鹽酸的體積(mL) | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化學(xué) 來源:2010年寧波市八校高二下學(xué)期期末聯(lián)考化學(xué)試題 題型:實(shí)驗(yàn)題
(11分)為測(cè)定含有Na2O雜質(zhì)的Na2O2樣品的純度,甲、乙二位同學(xué)設(shè)計(jì)了二種不同的實(shí)驗(yàn)方案。
已知:2Na2O2+2CO2=== 2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
甲:用圖l所示裝置,通過測(cè)定Na2O2與CO2反應(yīng)生成O2的體積來測(cè)定樣品的純度。
(1)C中所盛的藥品是: 。
(2)A中橡皮管的作用是: 。
(3)利用該實(shí)驗(yàn)方案所測(cè)Na2O2的純度明顯偏大,其原因可能是 (填選項(xiàng)字母)。
a.裝置A、B中的空氣對(duì)測(cè)定結(jié)果產(chǎn)生了影響
b.裝置C中的空氣對(duì)測(cè)定結(jié)果產(chǎn)生了影響
c.讀數(shù)時(shí)U形量氣管中的液面左高右低
d.讀數(shù)時(shí)U形量氣管中的液面左低右高
乙:稱取3.500 g試樣,配成1000.00 mL溶液,用0.1000 mol·L-1的標(biāo)準(zhǔn)鹽酸滴定。
(4)取上述所配溶液25.00 mL于錐形瓶中,操作如下圖所示(手持部分省略):正確的操作是圖 ,取溶液所用儀器的名稱是 。

(5)滴定操作平行實(shí)驗(yàn)的數(shù)據(jù)記錄如下表:
|
滴定次數(shù) |
第一次滴定 |
第二次滴定 |
第三次滴定 |
|
消耗標(biāo)準(zhǔn)鹽酸的體積(mL) |
24.98 |
25.00 |
25.02 |
由表中數(shù)據(jù)計(jì)算樣品中Na2O2純度為 。
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com