
【題目】氨是重要的氮肥,合成原理為:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列問題:
2NH3(g)△H=﹣92.4kJ/mol.回答下列問題:
(1)寫出平衡常數K的表達式 , 如果降低溫度,該反應K值E,化學反應速率 , N2的轉化率(填“增大”、“減小”或“不變”).
(2)在500℃、20MPa時,將N2、H2置于一個容積為2L的密閉容器中發生反應,反應過程中各種物質的量變化如圖所示,回答下列問題: 
①10min內以NH3表示的平均反應速率: .
②在10~20min內:NH3濃度變化的原因可能是
A.加了催化劑 B.縮小容器體積
C.降低溫度 D.增加NH3物質的量
③第1次平衡的時間為: , 第2次平衡的時間為: , 第1次平衡:平衡常數K1=(帶數據的表達式),第2次平衡時NH3的體積分數;
④在反應進行至25min時,曲線發生變化的原因: ,
達第二次平衡時,新平衡的平衡常數K2K1 , (填“大于”、“小于”或“等于”).
【答案】
(1)K= ![]() ;減小;增大
;減小;增大
(2)0.005mol/(L.min);A;20﹣25min;35﹣40min;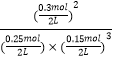 ;45.5%;移走0.1molNH3;等于
;45.5%;移走0.1molNH3;等于
【解析】解:(1)化學平衡常數是平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,所以N2(g)+3H2(g) ![]() 2NH3(g),該反應的平衡常數表達式K=
2NH3(g),該反應的平衡常數表達式K= ![]() ;化學反應隨溫度的升高反應速率加快,隨溫度的降低,反應速率減慢,所以降低溫度虎穴反應速率減慢;化學平衡的反應,降低溫度向吸熱的方向移動,該反應正反應為放熱反應,降低溫度,化學平衡向正反應方向移動,所以氮氣的轉化率增大,
;化學反應隨溫度的升高反應速率加快,隨溫度的降低,反應速率減慢,所以降低溫度虎穴反應速率減慢;化學平衡的反應,降低溫度向吸熱的方向移動,該反應正反應為放熱反應,降低溫度,化學平衡向正反應方向移動,所以氮氣的轉化率增大,
所以答案是: ![]() ;減少;增大;(2)①根據反應速率v(NH3)=
;減少;增大;(2)①根據反應速率v(NH3)= ![]() =
= ![]() =0.005mol/(L.min),
=0.005mol/(L.min),
所以答案是:0.005mol/(L.min);
②由圖象可知各組分物質的量變化增加,且10min時變化是連續的,20min達平衡時,△n(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物質的量變化之比等于化學計量數之比,三種氣體物質的速率增加倍數相同,說明10min可能改變的條件是使用催化劑,縮小體積相當于增大壓強,應該反應物的速率增加倍數大,降低溫度,應該反應速率減小,增加NH3物質的量,逆反應速率增加的倍數大,故只有使用催化劑符合,
故選A;
③由圖象可以看出,當反應進行到時20﹣25min,各物質的量不變,說明反應達到平衡狀態,化學平衡常數等于生成物濃度冪之積與反應物濃度冪之積的比,由圖象可知,20min達平衡時,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以所以其平衡常數K= ![]() =
= 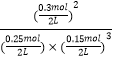 =426.7;第2次平衡時NH3的體積分數=
=426.7;第2次平衡時NH3的體積分數= ![]() ×100%=45.5%,
×100%=45.5%,
所以答案是:20﹣25min,35﹣40min; 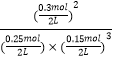 ;45.5%;
;45.5%;
④第25分鐘,NH3的物質的量突然減少,而H2、N2的物質的量不變,說明應是分離出NH3;由圖象可以看出,當反應進行到時35﹣40min,各物質的量不變,說明反應達到第二次平衡狀態,平衡常數只受溫度影響,溫度不變,平衡常數不變,所以抽去0.1mol氨,此時平衡常數K將不變;
所以答案是:分離出0.1molNH3;等于;
【考點精析】本題主要考查了反應速率的定量表示方法和化學平衡常數的含義的相關知識點,需要掌握反應速率的單位:mol/(L·min)或mol/(L·s) v=△c-△t;指在一定條件下的可逆反應里,正反應和逆反應的速率相等,反應混合物中各組分的濃度不變的狀態才能正確解答此題.


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】氨是重要的氮肥,合成原理為:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92.4kJ/mol.回答下列問題:
2NH3(g)△H=﹣92.4kJ/mol.回答下列問題:
(1)寫出平衡常數K的表達式 , 如果降低溫度,該反應K值E,化學反應速率 , N2的轉化率(填“增大”、“減小”或“不變”).
(2)在500℃、20MPa時,將N2、H2置于一個容積為2L的密閉容器中發生反應,反應過程中各種物質的量變化如圖所示,回答下列問題: 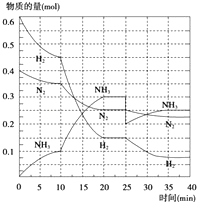
①10min內以NH3表示的平均反應速率: .
②在10~20min內:NH3濃度變化的原因可能是
A.加了催化劑 B.縮小容器體積
C.降低溫度 D.增加NH3物質的量
③第1次平衡的時間為: , 第2次平衡的時間為: , 第1次平衡:平衡常數K1=(帶數據的表達式),第2次平衡時NH3的體積分數;
④在反應進行至25min時,曲線發生變化的原因: ,
達第二次平衡時,新平衡的平衡常數K2K1 , (填“大于”、“小于”或“等于”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五種溶液,用一種試劑就可把它們鑒別開來,這種試劑是
A.鹽酸 B.燒堿溶液 C.氨水 D.KSCN溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)在一可變容積的密閉容器中進行,試回答:
Fe3O4(s)+4H2(g)在一可變容積的密閉容器中進行,試回答:
(1)增加Fe的量,其反應速率(填“增大”、“不變”或“減小”,下同).
(2)將容器的體積縮小一半,其反應速率 .
(3)保持體積不變,充入N2使體系壓強增大,其反應速率 .
(4)保持壓強不變,充入N2使容器的體積增大,其反應速率 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于聚乙烯的說法正確的是( )
A. 聚乙烯是通過加聚反應生成的
B. 聚乙烯具有固定的元素組成,因而有固定的熔、沸點
C. 聚乙烯塑料袋因有毒,故不能裝食品
D. 聚乙烯因性質穩定,故不易造成污染
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2A+B3C+4D中,表示該反應速率最快的是( )
A.v(A)=0.7molL﹣1S﹣1
B.v(B)=0.3 molL﹣1S﹣1
C.v(C)=0.8molL﹣1S﹣1
D.v(D)=1 molL﹣1S﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】體積為V mL、密度為ρ gcm﹣3的溶液,含有相對分子質量為M的溶質m g,其物質的量濃度為c molL﹣1 , 溶質的質量分數為W%,下列表示式中不正確的是( )
A.c= ![]()
B.m= ![]()
C.W%= ![]() %
%
D.c= ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,不正確的是( )
A.σ鍵比π鍵的重疊程度大,形成的共價鍵強度大
B.兩個原子之間形成共價鍵時,最多有一個σ鍵
C.氣體單質中,一定有σ鍵,可能有π鍵
D.N2分子中有一個σ鍵、2個π鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com