
分析 (1)As2S3和SnCl2在鹽酸中反應轉化為As4S4和SnCl4并放出H2S氣體,反應的方程式為2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根據方程式或化合價的變化判斷;
(2)根據反應物中某元素化合價的降低來分析氧化劑,酸性氣體用堿性溶液吸收;
(3)As2S3和濃HNO3反應生成H3AsO4、S和NO2,反應的離子方程式為:As2S3+10H++10NO3-=2H3AsO4+3S↓+10NO2↑+2H2O,反應中As的化合價升高,N元素的化合價降低,原電池中得電子的物質在正極反應.
解答 解:(1)根據電子得失守恒知1molAs2S3作氧化劑得到2mol電子,而1molSnCl2作還原劑失去2mol電子,所以二者的物質的量之比是1:1,
故答案為:1:1;
(2)反應中As2S3中的As元素化合價降低,As2S3為氧化劑,H2S為酸性氣體,可用NaOH溶液吸收;
故答案為:As2S3;NaOH溶液;
(3)As2S3和濃HNO3反應生成H3AsO4、S和NO2,反應的離子方程式為:As2S3+10H++10NO3-=2H3AsO4+3S↓+10NO2↑+2H2O,反應中As的化合價升高,N元素的化合價降低,若生成2mol H3AsO4,則反應中轉移電子的物質的量為10mol,原電池中得電子的物質在正極反應,則硝酸根離子在正極得電子生成NO2,
故答案為:10mol;正極.
點評 本題考查了氧化還原反應,涉及了氧化還原反應的配平、氧化劑、氧化產物的判斷及分析電子轉移的數目,題目難度中等,側重于考查學生的分析能力和計算能力.


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
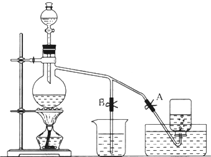 如圖表示在沒有通風櫥的條件下制備氯氣時設計的裝置,圖中A、B是可控制的彈簧鐵夾.(已知:氯氣在飽和氯化鈉溶液中的溶解度較小.)
如圖表示在沒有通風櫥的條件下制備氯氣時設計的裝置,圖中A、B是可控制的彈簧鐵夾.(已知:氯氣在飽和氯化鈉溶液中的溶解度較小.)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 下表給出五種元素的相關信息,根據以下信息填空:
下表給出五種元素的相關信息,根據以下信息填空:| 元素 | 相關信息 |
| A | 基態原子2p能級有3個單電子 |
| B | 基態原子p軌道上成對電子數等于未成對電子數 |
| C | 氫化物常用于刻蝕玻璃 |
| D | 基態原子核外電子分處6個不同能級,且每個能級均已排滿 |
| E | 原子序數等于C與D的原子序數之和 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若向H2SO3,溶液中加入氯化鈣溶液,平衡向右移動,會產生亞硫酸鈣沉淀. | |
| B. | 若向H2S03溶液巾加人氫氧化鈉溶液,平衡向右移動,pH變大 | |
| C. | 適當升溫(假如亞硫酸不分解不揮發),平衡向左移動,電離平衡常數減小 | |
| D. | 25℃時,笫一步電離常數K,小于第二步電離常數K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
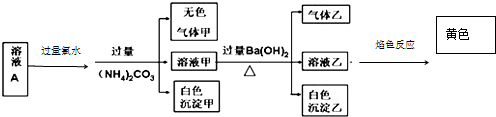
| A. | 沉淀乙一定可溶于鹽酸 | |
| B. | 溶液中一定存在 Na+、Al3+,一定沒有 Fe3+、Fe2+、CO32- | |
| C. | 溶液中一定有 SO42-,可能有 K+、Cl- | |
| D. | 氣體甲、乙均為無色、有刺激性氣味 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com