
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.分析 由元素在周期表中位置,可知A為Na、B為鉀、C為Mg、D為Al、E為碳、H為Si、R為氮、F為氧、I為硫、G為Cl.
(1)R單質分子為N2,分子中氮原子之間形成3對共用電子對;
(2)金屬性越強,最高價氧化物對應水化物的堿性越強;
(3)電子層結構相同,核電荷數越大離子半徑越小,電子層越多離子半徑越大;
(4)鈉與水反應生成氫氧化鈉與氫氣;
(5)X的氫氧化物既能溶于氫氧化鈉溶液中反應,也能與鹽酸反應,則X為Al.
解答 解:由元素在周期表中位置,可知A為Na、B為鉀、C為Mg、D為Al、E為碳、H為Si、R為氮、F為氧、I為硫、G為Cl.
(1)R單質分子為N2,分子中氮原子之間形成3對共用電子對,電子式為: ,故答案為:
,故答案為: ;
;
(2)同周期自左而右金屬性減弱,故金屬性Na>Mg>Al,金屬性越強,最高價氧化物對應水化物的堿性越強,故堿性:NaOH>Mg(OH)2>Al(OH)3,故答案為:NaOH;
(3)電子層結構相同,核電荷數越大離子半徑越小,電子層越多離子半徑越大,故離子半徑:K+>Na+>Mg2+,故答案為:K+>Na+>Mg2+;
(4)鈉與水反應生成氫氧化鈉與氫氣,化學反應方程為:2Na+2H2O=2NaOH+H2↑,故答案為:2Na+2H2O=2NaOH+H2↑;
(5)X的氫氧化物既能溶于氫氧化鈉溶液中反應,也能與鹽酸反應,則X為Al,位于周期表中,故答案為:Al;第3周期第ⅢA族.
點評 本題考查元素周期表與元素周期律,比較基礎,注意整體把握元素周期表的結構,掌握微粒半徑比較規律.


 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源: 題型:解答題
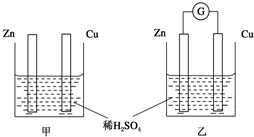 分別按如圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,乙中G為電流計.請回答下列問題:
分別按如圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,乙中G為電流計.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 電池工作時,正極反應式為:O2+2 H2O+4e-=4OH- | |
| B. | 電解時,a 電極周圍首先放電的是Cl- | |
| C. | 電解時,電子流動路徑是:負極→外電路→陰極→溶液→陽極→正極 | |
| D. | 忽略能量損耗,當電池中消耗0.2g H2時,b極周圍會產生2.24LH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,1L0.1mol•L-1的NH4NO3溶液中氮原子數為0.2NA | |
| B. | 在密閉容器中加入1.5 mol H2和0.5 molN2,充分反應后可得到NH3分子數為NA | |
| C. | 在反應KIO3+6HI=KI+3I2+3H2O中,每生成3molI2轉移的電子數為6NA | |
| D. | 標準狀況下,22.4 L的CCl4中C-Cl鍵數為4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
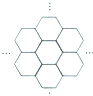 據報道,科學家己經研制出世界上最薄的材料一碳膜片,其厚度只有一根頭發的二十萬分之一.如圖所示,這種碳膜片狀如蜂巢,是由碳原子構成的六邊形單元向外延展而成,下列有關碳膜片的說法中,正確的是( )
據報道,科學家己經研制出世界上最薄的材料一碳膜片,其厚度只有一根頭發的二十萬分之一.如圖所示,這種碳膜片狀如蜂巢,是由碳原子構成的六邊形單元向外延展而成,下列有關碳膜片的說法中,正確的是( )| A. | 碳膜片屬于單質 | |
| B. | 碳膜片與C60是同一種物質 | |
| C. | 碳膜片屬于人工合成的有機高分子材料 | |
| D. | 碳膜片在氧氣中完全燃燒的產物和碳在氧氣中完全燃燒的產物不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在金屬元素與非金屬元素的分界線附近可以尋找制備半導體材料的元素 | |
| B. | 在過渡元素中可以尋找制備催化劑及耐高溫和耐腐蝕的元素 | |
| C. | 在非金屬元素區域可以尋找制備新型農藥材料的元素 | |
| D. | 在地球上元素的分布和它們在元素周期表中的位置有密切關系 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com