
| A. | 原子半徑A<B<C | B. | A的氫化物的穩定性大于C的氫化物 | ||
| C. | B的氧化物熔點比A的氧化物高 | D. | A與C可形成離子化合物 |
分析 A與C同主族,B原子最外層電子數等于A原子次外層電子數,主族元素最外層電子數不超過8,故A元素原子只能有2個電子層,A處于第二周期,B原子最外層電子數為2,故B處于ⅡA族.它們的原子的最外層電子數之和為10,可知A、C的最外層電子數為4,故A為C元素、C為Si元素,A、B、C原子序數依次遞增,則B為Mg元素,據此解答.
解答 解:A與C同主族,B原子最外層電子數等于A原子次外層電子數,主族元素最外層電子數不超過8,故A元素原子只能有2個電子層,A處于第二周期,B原子最外層電子數為2,故B處于ⅡA族.它們的原子的最外層電子數之和為10,可知A、C的最外層電子數為4,故A為C元素、C為Si元素,A、B、C原子序數依次遞增,則B為Mg元素.
A.A為C元素,B為Mg元素,C為Si元素,同周期隨原子序數增大原子半徑減小,同主族自上而下原子半徑增大,所以原子半徑為C<Si<Mg,故A錯誤;
B.同主族自上而下非金屬性減弱,非金屬性越強,氫化物的越強,非金屬性C>Si,故氫化物的穩定性CH4>SiH4,故B正確;
C.A的氧化物為分子晶體,B的氧化物為離子晶體,B的氧化物的熔點比A的氧化物高,故C正確;
D.A與C形成的化合物為SiC,為共價化合物,故D錯誤.
故選:BC.
點評 本題考查原子結構與元素周期律的關系,題目難度不大,本題注意晶體類型的區別.


 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液和Al2(SO4)3溶液加熱蒸干,灼燒都得到Al2O3 | |
| B. | 25℃時,Mg(OH)2固體在蒸餾水、鹽酸和氯化銨溶液中的Ksp大小順序為:鹽酸>氯化銨>蒸餾水 | |
| C. | 已知25℃時,NH4F溶液顯酸性,則電離常數K(NH3•H2O)<K(HF) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2 | B. | Cl2 | C. | HCl | D. | H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是強酸 | |
| B. | 將銅片放入濃硫酸中,無明顯現象是因為銅片發生了鈍化 | |
| C. | 硫粉在過量的純氧中燃燒可以生成大量的SO3 | |
| D. | 富含硫黃的礦物在工業上可用于制造硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
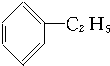 ②
②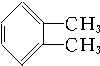 ③
③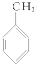 ④
④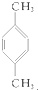
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸化學式 | CH3COOH | HCN | H2CO3 |
| 電離平衡常數(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1 mol•L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 升高溫度,HCN溶液中H+濃度增大,平衡正向移動,電離平衡常數增大 | |
| C. | 向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的電離平衡都正向移動 | |
| D. | 向CH3COOH溶液中加入少量氫氧化鈉固體,平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入無水CuSO4,再過濾 | |
| B. | 加入生石灰,再蒸餾 | |
| C. | 加入濃H2SO4,再加熱,蒸出乙醇 | |
| D. | 將96%的乙醇溶液直接加熱蒸餾出來 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com