
【題目】氨氣是重要的化工原料。
(1)檢驗氨氣極易溶于水的簡單操作是:收集一試管氨氣,______________。
(2)往飽和食鹽水中依次通入足量的NH3和足量的CO2,生成沉淀的化學式為_________;過濾后,使余液盡可能析出較多NH4Cl晶體的方法是:再通入足量的NH3、冷卻并加入________,請說明這樣操作為什么可以析出較多NH4Cl的原因:_________________。某NaHCO3晶體中含有NaCl雜質,某同學在測定其中NaHCO3的含量時,稱取5.000g試樣,定容成100mL溶液,用標準鹽酸溶液滴定(用甲基橙做指示劑),測定數據記錄如下:
滴定次數 | 待測液(mL) | 0.5000mol/L鹽酸溶液的體積(mL) | |
初讀數 | 終讀數 | ||
第一次 | 20.00 | 1.00 | 21.00 |
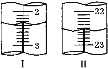
第二次 | 20.00 | 如圖Ⅰ | 如圖Ⅱ |
(3)定容過程中需要用到的儀器有燒杯、玻璃棒、___________和____________。
(4)當滴定至__________________________,即為滴定終點;第二次滴定,從圖I圖II顯示消耗的鹽酸溶液體積為_________mL。
(5)該實驗測定樣品中NaHCO3的質量分數為__________(保留2位小數)。
(6)若該同學測定結果偏大,請寫出一個造成該誤差的原因_____________。
【答案】倒插入水中,水迅速充滿試管 NaHCO3 NaCl 足量的NH3、冷卻并加入NaCl,能夠增大NH4+和Cl-的濃度,使平衡NH4Cl(s)NH4+(aq)+Cl-(aq)逆向移動 100mL容量瓶 膠頭滴管 溶液由橙色變成黃色,且半分鐘內部變色 20.20 84.42% 滴定管用蒸餾水洗滌后,直接注入標準酸液進行滴定(或滴定前有氣泡,滴定后氣泡消失或錐形瓶用待測液潤洗了等)
【解析】
(1)根據氨氣極易溶于水分析解答;
(2)根據侯氏制堿法的反應原理分析判斷;結合NH4Cl飽和溶液中存在NH4Cl(s)NH4+(aq)+Cl-(aq)的平衡分析解答;
(3)根據定容的操作分析解答;
(4) 碳酸氫鈉溶液顯堿性,用甲基橙做指示劑時,開始時溶液顯橙色,解甲基橙的變色范圍分析判斷;根據滴定管的結構結合圖I圖II讀出初讀數和終讀數,再計算消耗的鹽酸溶液體積;
(5)計算兩次消耗鹽酸的平均值,計算消耗鹽酸的物質的量,依據方程式:HCl+NaHCO3=NaCl+H2O+CO2↑,然后計算碳酸氫鈉的物質的量和質量,計算其質量分數;
(6)根據c(待測)=![]() ,測定結果偏大,造成該誤差的原因為V(標準)偏大,結合造成V(標準)偏大的可能因素解答。
,測定結果偏大,造成該誤差的原因為V(標準)偏大,結合造成V(標準)偏大的可能因素解答。
(1)檢驗氨氣易溶于水的簡單操作是:收集一試管氨氣,將試管倒插入水中,水迅速充滿試管,故答案為:倒插入水中,水迅速充滿試管;
(2)根據侯氏制堿法的反應原理,往飽和食鹽水中依次通入足量的NH3和足量的CO2,可生成碳酸氫鈉沉淀;NH4Cl飽和溶液中存在NH4Cl(s)NH4+(aq)+Cl-(aq),為盡可能析出較多NH4Cl晶體,可以向溶液中再通入足量的NH3、冷卻并加入NaCl,可使平衡逆向移動,故答案為:NaHCO3;NH3;NaCl;足量的NH3、冷卻并加入NaCl,能夠增大NH4+和Cl-的濃度,使平衡NH4Cl(s)NH4+(aq)+Cl-(aq)逆向移動;
(3)定容過程中需要用到的儀器有燒杯、玻璃棒、100mL容量瓶和膠頭滴管,故答案為:100mL容量瓶;膠頭滴管;
(4) 用甲基橙做指示劑,用標準鹽酸溶液滴定NaHCO3,碳酸氫鈉溶液顯堿性,開始時溶液顯橙色,當滴入最后一滴鹽酸,溶液由橙色變成黃色,且半分鐘內部變色,即為滴定終點;根據圖I圖II,初讀數為2.40 mL,終讀數為22.60mL,則消耗的鹽酸溶液體積20.20 mL,故答案為:溶液由橙色變成黃色,且半分鐘內部變色;20.20 ;
(5)第一次消耗鹽酸的體積是21.00mL-1.00mL=20.00mL,所以兩次消耗鹽酸的平均值是![]() =20.10mL,所以消耗鹽酸的物質的量是0.0201L×0.5000mol/L;根據方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氫鈉的物質的量是0.0201L×0.5000mol/L,質量是0.0201L×0.5000mol/L×84g/mol,所以碳酸氫鈉的純度是
=20.10mL,所以消耗鹽酸的物質的量是0.0201L×0.5000mol/L;根據方程式HCl+NaHCO3=NaCl+H2O+CO2↑可知,碳酸氫鈉的物質的量是0.0201L×0.5000mol/L,質量是0.0201L×0.5000mol/L×84g/mol,所以碳酸氫鈉的純度是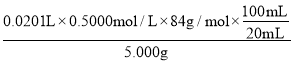 ×100%=84.42%,故答案為:84.42%;
×100%=84.42%,故答案為:84.42%;
(6)若該同學測定結果偏大,造成該誤差的原因可能是滴定管用蒸餾水洗滌后,直接注入標準酸液進行滴定(或滴定前有氣泡,滴定后氣泡消失或錐形瓶用待測液潤洗了等),故答案為:滴定管用蒸餾水洗滌后,直接注入標準酸液進行滴定(或滴定前有氣泡,滴定后氣泡消失或錐形瓶用待測液潤洗了等)。


科目:高中化學 來源: 題型:
【題目】白樺脂酸對白血病等惡性腫瘤細胞有抑制作用,其結構簡式如圖所示,在白樺脂酸中加入合適的試劑檢驗其官能團(必要時可加熱),下列試劑、現象、結論都正確的一項是

選項 | 試劑 | 現象 | 結論 |
A | 氯化鐵溶液 | 溶液變色 | 含有羥基 |
B | 銀氨溶液 | 有銀鏡產生 | 含有醛基 |
C | 碳酸氫鈉溶液 | 有氣泡產生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳雙鍵 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太陽能為熱源分解Fe3O4,經熱化學鐵氧化合物循環分解水制H2的過程如下:
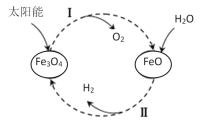
過程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
過程Ⅱ:……
下列說法不正確的是( )
A.過程Ⅰ中每消耗232gFe3O4轉移2mol電子
B.過程Ⅱ熱化學方程式為:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.過程Ⅰ、Ⅱ中能量轉化的形式依次是:太陽能→化學能→熱能
D.鐵氧化合物循環制H2具有成本低、產物易分離等優點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】東晉《華陽國志南中志》卷四中已有關于白銅的記載,云南鎳白銅(銅鎳合金)文明中外,曾主要用于造幣,亦可用于制作仿銀飾品。回答下列問題:
(1)鎳元素基態原子的價電子排布式為_________,3d能級上的未成對的電子數為______。
(2)硫酸鎳溶于氨水形成[Ni(NH3)6]SO4藍色溶液。
①[Ni(NH3)6]SO4中SO42-的立體構型是_____。
②在[Ni(NH3)6]2+中Ni2+與NH3之間形成的化學鍵稱為______ ,提供空軌道的中心微粒是_____。
③氨的沸點_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“極性”或“非極性”),中心原子的軌道雜化類型為_______。
(3)單質銅及鎳都是由______鍵形成的晶體:元素銅與鎳的第二電離能分別為:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某鎳白銅合金的立方晶胞結構如圖所示。
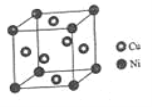
①晶胞中鎳原子與銅原子的數量比為_____。
②若合金的密度為dg/cm3,晶胞參數a=________nm
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物M是一種常用香料的主要成分之一,其合成路線如下。
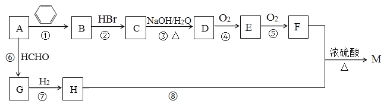
已知:
①相同條件下1體積烴A完全燃燒消耗4體積氧氣;
②RC≡CH+HCHO![]() RC≡CCH2OH;
RC≡CCH2OH;
③反應①的原子利用率為100%,反應類型屬于加成反應;
④M的分子式為C13H18O2。
回答下列問題:
(1)A的名稱為___________;G分子中有___ _個碳原子在同一條直線上。
(2)反應②~⑧中屬于加成反應的是______;H中官能團的名稱為___________。
(3)物質M的結構簡式為____________。B的一種同類別異構體存在順反異構,該物質發生加聚反應生成的高分子化合物的結構簡式為_____________。
(4)反應③的化學反應方程式為_______________。
(5)符合下列條件的F的同分異構體共有_____種。
①能發生銀鏡反應;②能發生水解反應;③屬于芳香族化合物。
其中核磁共振氫譜為4組峰,且峰面積之比為6∶2∶1∶1的為 (任寫一種物質的結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機合成工廠以植物秸稈或木材為初始原料經過生物發酵,制備聚酯纖維H和醫藥中間體E,其合成路線如下圖所示:
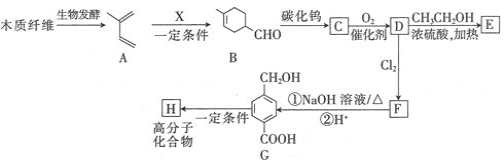
已知:①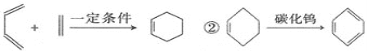
回答下列問題:
(1)A的化學名稱是________;B所含官能團的名稱是________。
(2)X的結構簡式________;G→H的反應類型是________。
(3)D→E的化學方程式________。
(4)符合下列條件的G同分異構體共有________種;其中核磁共振氫譜有五組峰的結構簡式________。
①能發生銀鏡反應;②能與FeCl3溶液發生顯色反應;③能發生水解反應。
(5)參照上述合成路線,利用CH2=CH-CH=CH2為初始原料設計合成![]() 的路線_______________。
的路線_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是![]()
![]() 氧化還原反應的實質是電子的轉移
氧化還原反應的實質是電子的轉移
![]() 若1mol氣體的體積為
若1mol氣體的體積為![]() ,則它一定處于標準狀況下
,則它一定處于標準狀況下
![]() 標準狀況下,1LHCl和1L
標準狀況下,1LHCl和1L![]() 的物質的量相同
的物質的量相同
![]() 溶于水得到的溶液可以導電的化合物就是電解質
溶于水得到的溶液可以導電的化合物就是電解質
![]() 利用丁達爾現象區別溶液和膠體
利用丁達爾現象區別溶液和膠體
![]() 兩種物質的物質的量相同,則它們在標準狀況下的體積也相同
兩種物質的物質的量相同,則它們在標準狀況下的體積也相同
![]() 在同溫、同體積時,氣體物質的物質的量越大,則壓強越大
在同溫、同體積時,氣體物質的物質的量越大,則壓強越大
![]() 同溫同壓下,氣體的密度與氣體的相對分子質量成正比
同溫同壓下,氣體的密度與氣體的相對分子質量成正比
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水中可以獲得淡水、食鹽,并可提取鎂和溴等物質。
(1)海水淡化的方法有_______(填一種)。
(2)寫出元素鈉在元素周期表中的位置:_______。
(3)從海水中提取鎂的流程如下圖所示:
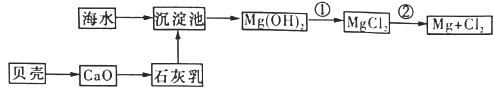
反應①的離子方程式為_______________。
反應②的化學方程式為_______________。
(4)從海水中提取溴的主要步驟是向濃縮的海水中通人氯氣,將溴離子氧化,該反應的離子方程式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】沼氣的主要成分是CH4,還含有CO2、H2S等。Jo De Vrieze等設計了利用膜電解法脫除沼氣中的CO2和H2S,并將陰極處理后氣體制成高純度生物甲烷,其流程如圖所示。
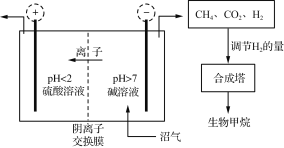
(1) 需控制電解槽中陰極室pH>7,其目的是________________。
(2) 陽極室逸出CO2和________(填化學式);H2S在陽極上轉化為SO42-而除去,其電極反應式為___________________。
(3) 在合成塔中主要發生的反應為:
反應Ⅰ: CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1
反應Ⅱ: CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
調節![]() =4,充入合成塔,當氣體總壓強為0.1 MPa,平衡時各物質的物質的量分數如圖1所示;不同壓強時,CO2的平衡轉化率如圖2所示:
=4,充入合成塔,當氣體總壓強為0.1 MPa,平衡時各物質的物質的量分數如圖1所示;不同壓強時,CO2的平衡轉化率如圖2所示:
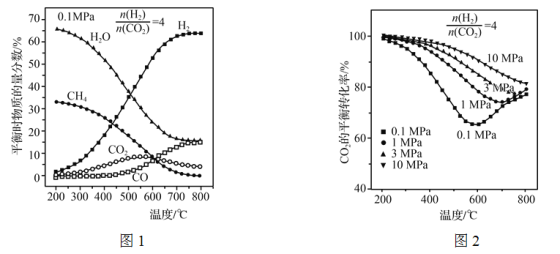
①反應CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=________(用ΔH1、ΔH2表示)。
②圖1中,200~550 ℃時,CO2的物質的量分數隨溫度升高而增大的原因是__________。
③圖2中,相同溫度下,壓強越大,CO2的平衡轉化率越大,其原因是___________________;在壓強為10 MPa時,當溫度在200~800 ℃范圍內,隨溫度升高,CO2的平衡轉化率始終減小,其原因是________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com