
 熱化學方程式中的H實際上是熱力學中的一個物理量,叫做焓.一個體系的焓(H)的絕對值到目前為止還沒有辦法測得,但當體系發生變化時,我們可以測得體系的焓的變化,即焓變,用“△H”表示,△H=H(終態)-H(始態).
熱化學方程式中的H實際上是熱力學中的一個物理量,叫做焓.一個體系的焓(H)的絕對值到目前為止還沒有辦法測得,但當體系發生變化時,我們可以測得體系的焓的變化,即焓變,用“△H”表示,△H=H(終態)-H(始態).分析 (1)化學反應過程中一定伴隨著能量的變化,反應焓變主要是指反應前后的熱量變化;依據能量守恒分析焓變,結合焓變計算:△H=H(終態)-H(始態),H確定反應吸熱放熱;△H<0為放熱反應;△H>0為吸熱反應;
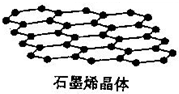
(2)石墨晶體結構如圖,1mol碳形成1.5mol的碳碳鍵,所以C(s、石墨)+O2(g)═CO2(g);△H=+$(\frac{3}{2}a+b-2c)kJ•mo{l}^{-1}$;
(3)依據蓋斯定律的含義,化學反應的△H便是定值,與反應的途徑無關,結合熱化學方程式計算得到;
解答 解:(1)化學反應過程中一定伴隨著能量的變化,反應焓變主要是指反應前后的熱量變化;對于化學反應A+B=C+D,若H(A)+H(B)>H(C)+H(D):△H=H(終態)-H(始態),判斷可知△H<0;反應是放熱反應;
故答案為:小于; 放熱;
(2)石墨晶體結構如圖,1mol碳形成1.5mol的碳碳鍵,所以C(s、石墨)+O2(g)═CO2(g);△H=+$(\frac{3}{2}a+b-2c)kJ•mo{l}^{-1}$;故答案為:C(s、石墨)+O2(g)═CO2(g);△H=+$(\frac{3}{2}a+b-2c)kJ•mo{l}^{-1}$;
(3)依據蓋斯定律
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ•mol-1
①×3-③×2+②得到:6FeO(s)+6CO(g)═6Fe(s)+6CO2(g)△H=-66 kJ•mol-1
得到熱化學方程式為:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ•mol-1
故答案為:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ•mol-1
點評 本題考查了反應的能量變化,反應的焓變計算方法,焓變與物質焓的計算關系,蓋斯定律的計算應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | NaOH溶液(Ba(OH)2):用K2SO4溶液 | B. | NaCl溶液(Na2SO4):用Ba(NO3)2溶液 | ||
| C. | KOH溶液K2CO3:用CaCl2溶液 | D. | HNO3溶液(HCl):用AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上用惰性電極電解熔融的MgO可制得Mg | |
| B. | 氫氧化鋁、氫氧化鈉、碳酸鈉都是常見的胃酸中和劑 | |
| C. | 草木灰可與銨態氮肥混合施用 | |
| D. | 為加快漂白精的漂白速率,使用時可滴加幾滴醋酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na和O2 | B. | NaOH和CO2 | C. | AlCl3和NaOH | D. | Na2O2和CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
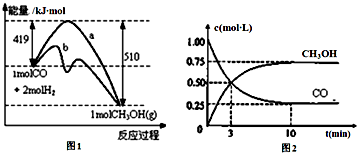 工業上用CO生產燃料甲醇.一定溫度和容積條件下發生反應:CO(g)+2H2(g)?CH3OH(g).圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol
工業上用CO生產燃料甲醇.一定溫度和容積條件下發生反應:CO(g)+2H2(g)?CH3OH(g).圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com