
分析 (1)Fe3+遇到KSCN溶液呈紅色;
(2)Cu2O遇到酸產生Cu,Cu能與Fe3+反應;
(3)若固體全部溶解,則一定存在Fe2O3和Cu2O,根據物質的相關性質書寫反應的有關離子方程式
(4)依據題意,能發生反應的物質為Cu2O,最后變成CuO,增加的質量就是反應的氧氣的質量,根據質量差計算可以得出Cu2O的質量分數.
解答 解:(1)若假設1成立,則溶液中含有Fe3+,遇到KSCN溶液呈紅色,故答案為:固體完全溶解,溶液呈血紅色;
(2)如果混合物中含有Cu2O,遇到酸產生Cu,Cu能與Fe3+反應:2Fe3++Cu=2Fe2++Cu2+,則加入KSCN溶液也不變色,故此種說法不正確,
故答案為:不合理;當原粉末為Fe2O3和Cu2O的混合物時,加入稀硫酸后產生的Fe3+全部與Cu反應生成Fe2+,滴加KSCN溶液后也不變紅色;
(3)固體全部溶解,則一定存在Fe2O3和Cu2O,因為Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必須有Fe2O3存在,使其生成的Fe3+溶解產生的Cu,涉及反應的有關離子方程式為Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案為:Fe2O3和Cu2O;
(4)依據題意,能發生反應的物質為Cu2O,最后變成CuO,增加的質量就是反應的氧氣的質量,根據質量差計算可以得出Cu2O的質量分數.
設樣品中氧化亞銅的質量為m,
2Cu2O+O2═4CuO△m
288g 32g
m (b-a)g
m=$\frac{288×(b-a)g}{32g}$=9(b-a)g,混合物中Cu2O的質量分數為$\frac{9(b-a)}{a}×100%$,
故答案為:$\frac{9(b-a)}{a}×100%$.
點評 本題考查實驗的設計及評價,以及物質的組成的測定,并涉及運用差量法進行計算,本題難度較大,做題時注意把握題給信息.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
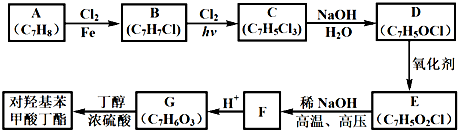
 .
.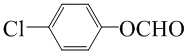 (寫一種結構簡式)
(寫一種結構簡式)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
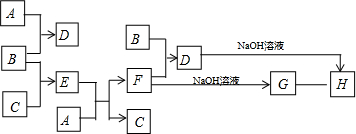
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陰離子符號 | 物質的量濃度(mol•L-1) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A、D兩種元素形成的化合物中只含有極性鍵 | |
| B. | A、C、D三種元素形成的化合物一定是共價化合物,其溶液一定呈酸性 | |
| C. | 原子半徑由大到小的順序是F>E>C>D | |
| D. | 最高價氧化物對應水化物酸性最強的元素是C |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ③⑤⑨ | B. | ①③⑨ | C. | ③⑨⑩ | D. | ③⑦⑨ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com