
| 容器編號 | c(H2O)/mol/L | c(CO)/mol/L | c(H2)/mol/L | V正、V逆比較 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ② | V正=V逆 |
分析 (1)平衡常數為生成物、反應物濃度冪之積的比值,結合方程式列式;
(2)提高CO產率,應使平衡正向移動;
(3)由反應Ⅰ達到平衡狀態,可求出反應的平衡常數,根據平衡常數計算并判斷反應的進行方向;
(4)根據反應方程式利用三段式法計算,轉化的水蒸汽為x,根據體積之比等于物質的量之比計算;
(5)根據2.4gC與水反應生成的CO和H2的物質的量,利用熱化學方程式計算.
解答 解:(1)反應C(s)+H2O(g)?CO(g)+H2(g)中,C為固體,則K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$,故答案為:$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;
(2)A.正反應為吸熱反應,則升高溫度,平衡正向移動,CO的產率增大,故A正確;
B.降低壓強,平衡正向移動,CO的產率增大,故B正確;
C.增加固體的用量平衡不移動,故C錯誤;
D.通入H2平衡逆向移動,故D錯誤.
故答案為:AB;
(3)由反應Ⅰ達到平衡狀態可知,反應的平衡常數K=$\frac{0.1×0.60}{0.06}$=1,
反應Ⅱ中Qc=$\frac{0.4×0.5}{0.06}$=3.33>1,則反應向逆反應方向移動,即V正<V逆,
反應Ⅳ中V正=V逆,說明反應達平衡狀態,則有$\frac{0.3×c({H}_{2})}{0.12}=1$,c(H2)=0.4mol/L,
故答案為:①V正<V逆;②0.40;
(4)根據反應方程式利用三段式法計算,轉化的水蒸汽為x,根據體積之比等于物質的量之比計算,
C (s)+H216O(g)  C16O (g)+H2 (g)
C16O (g)+H2 (g)
起始:1mol 0 0
轉化:x x x
平衡:1-x x x
則有:$\frac{(1-x)+x+x}{1}=1.25$,x=0.25mol,所以轉化率為$\frac{0.25}{1}×\;100%$=25%,
增加固體的對反應速率和化學平衡都沒有影響,水蒸氣的轉化率不變,
恒溫恒壓下,再補充 a mol 水蒸氣 (H218O),平衡狀態不變,為等效平衡,水的轉化率相等,則有生成的C18O 的物質的量為a×25%=0.25a,
所以達平衡時C16O和C18O 的物質的量之比為0.25:0.25a=1:a,
故答案為:25%;不變;1:a;
(5)n(C)=$\frac{2.4g}{12g/mol}$=0.2mol,與水反應生成0.2molCO和0.2molH2,反應吸收的熱量為0.2mol×131.3KJ/mol=26.26KJ,
0.2molCO完全燃燒放出的熱量為0.2mol×283KJ/mol=56.6KJ,
0.2molH2完全燃燒放出的熱量為0.2mol×241.8KJ/mol=48.36KJ,
所以將2.4g 炭完全轉化為水煤氣,然后再燃燒,整個過程放出的熱量為56.6KJ+48.36KJ-26.26KJ=78.7KJ,
整個過程△H=-78.7kJ•mol-1,
故答案為:-78.7.
點評 本題考查化學平衡的有關計算,為高頻考點,側重于學生的分析能力和計算能力的考查,本題難度不大,做題時注意平衡常數的計算和應用.


科目:高中化學 來源: 題型:選擇題
| A. | 1 mol H2O中所含的粒子數目一定是NA | |
| B. | 1 molNH4+所含的質子數是10NA | |
| C. | 51 g NH3所含原子數為3NA | |
| D. | 氧氣的相對分子質量與2NA個氧原子質量(以g為單位)在數值上相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水調節pH | |
| B. | 除去金屬離子Cu2+、Hg2+,可向溶液中加入H2S、Na2S等沉淀劑 | |
| C. | 除去某溶液中的SO42-可向溶液中加入鎂鹽 | |
| D. | 除去ZnCl2溶液中的Fe3+可向溶液中加入ZnO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24 L CHCl3的原子總數為0.1 NA | |
| B. | 1 mol-OH中電子數為10 NA | |
| C. | 4.2 g C3H6中含有的碳碳雙鍵數一定為0.1 NA | |
| D. | 常溫常壓下,28 g丙烯和丁烯的混合氣體中含有的碳原子數為2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +CO2(g)?
+CO2(g)? +CO(g)+H2O(l)△H
+CO(g)+H2O(l)△H ?
?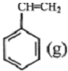 +H2(g)△H1=-125kJ/mol
+H2(g)△H1=-125kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蒸發操作時,應使混合物中的水分完全蒸干后,才能停止加熱 | |
| B. | 蒸餾操作時,應使溫度計水銀球靠近蒸餾燒瓶的支管口處 | |
| C. | 分液操作時,分液漏斗中下層液體從下口放出,上層液體從上口倒出 | |
| D. | 萃取操作時,應選擇有機萃取劑,且萃取劑不溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

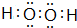 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com