
| A. | 若金屬鋅足量,反應所放出的氣體應為混合物 | |
| B. | 反應消耗的鋅的物質的量一定等于反應生成的氣體的物質的量 | |
| C. | 反應中所轉移的電子的物質的量一定等于反應生成的氣體的物質的量2倍 | |
| D. | 由于金屬鋁的活動性強于鋅,所以鋁與濃硫酸的反應一定比鋅與濃硫酸反應劇烈 |
分析 A.鋅與濃硫酸反應生成二氧化硫,與稀硫酸反應生成氫氣;
B.依據鋅與稀硫酸,濃硫酸反應方程式解答;
C.鋅與稀硫酸,濃硫酸反應,鋅都做還原劑失去電子生成二價鋅離子;
D.濃硫酸具有強的氧化性,常溫下與鋁發生鈍化.
解答 解:A.濃硫酸與金屬鋅反應時,濃度會逐漸減小,所以先發生反應:Zn+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,后發生反應:Zn+H2SO4(稀)═ZnSO4+H2↑,故A正確;
B.鋅與濃硫酸,稀硫酸反應方程式分別為:Zn+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)═ZnSO4+H2↑,金屬鋅與氣體的計量數之比都為1:1,故B正確;
C.依據鋅與濃硫酸,稀硫酸反應方程式:Zn+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,Zn+H2SO4(稀)═ZnSO4+H2↑,反應中的電子轉移情況均為生成1mol氣體轉移2mol電子,故C正確;
D.濃硫酸具有強的氧化性,由于常溫下金屬鋁在濃硫酸中發生鈍化,阻止反應進行,故D錯誤;
故選:D.
點評 本題考查了鋅與硫酸反應,明確濃硫酸、稀硫酸性質的區別是解題關鍵,注意鋁在常溫下與濃硫酸發生鈍化,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 700K時此反應速率最快 | |
| B. | 700K時氨的平衡濃度最大 | |
| C. | 700K時氨的轉化率最高 | |
| D. | 700K該反應的催化劑能發揮最大的作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 10℃20mL3 mol•L-1的X溶液 | B. | 20℃30 mL 2 mol•L-1的X溶液 | ||
| C. | 20℃10 mL 4 mol•L-1的X溶液 | D. | 10℃10 mL 2 mol•L-1的X溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自然界存在大量硅單質 | |
| B. | 自然界的硅易開采,且可再生 | |
| C. | 硅燃料便于運輸、貯存,從安全角度考慮,硅是優質燃料 | |
| D. | 硅燃料燃燒放出的熱量多,其燃燒產物對環境的污染容易有效地控制 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生成1molCu,轉移2mol電子 | B. | Cu是氧化產物 | ||
| C. | Cu2S既是氧化劑又是還原劑 | D. | 氧化劑只有Cu2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
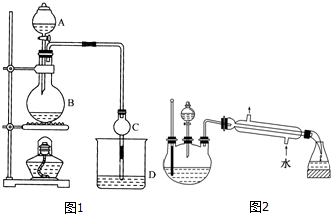
| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(NH3)=0.002mol(L•s) | B. | v(H2O)=0.002mol/(L•s) | ||
| C. | v(NO)=0.0015mol/(L•s) | D. | v(O2)=0.00125mol/(L•s) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com