
【題目】常溫下,濃度均為 0.1 mol·L-1 的鹽酸和醋酸,下列說法正確的是
A. 兩種溶液的 pH:鹽酸大于醋酸
B. 用相同濃度的 NaOH 溶液分別與等體積的鹽酸和醋酸溶液恰好反應完全,鹽酸消耗的 NaOH溶液體積多
C. 向醋酸中加入等物質的量的 NaOH,溶液呈堿性,且溶液中 ![]()
D. 兩種溶液中水電離出的氫離子:鹽酸大于醋酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某活動小組利用如圖實驗裝置制取氧氣并進行探究活動。

(1)寫出標號儀器的名稱:①_____,②____。
(2)用裝置A制取氧氣的化學方程式是____。若用裝置A、B、C來制取一瓶干燥的氧氣,裝置B中應盛放的是___,導管口的連接順序是_____。
(3)集氣瓶內收集到的氣體中氧氣的體積分數是多少呢?
[實驗驗證]活動小組設計了以下兩套實驗裝置,用來測定該瓶氣體中氧氣的體積分數。在氮氣環境下,將過量的銅粉分別裝入干燥的硬質玻璃管和具支試管后,密封。用兩支干燥的注射器從該瓶中抽取氣體,分別按圖M1-6連接,推拉注射器一段時間后,用酒精燈在銅粉部位加熱,加熱時反復推拉注射器至反應完全。

①甲裝置比乙裝置更合理,理由是_______。
②用甲裝置測定氧氣的體積分數,需要測定的實驗數據是_____。
[反思交流]實驗完畢,待裝置冷卻至室溫后,應先將氣球內的氣體全部擠出,再讀數,否則會使測得的實驗結果______ (填“偏大”偏小”或“無影響”),原因是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】世界能源消費的90%以上依靠化學技術。回答下列問題:
(1)質子交換膜燃料電池中作為燃料的H2通常來自水煤氣。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
則反應C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某實驗小組在實驗室模擬反應C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常數表達式為K=___________。一定溫度下,在2L盛有足量炭粉的恒容密閉容器中通入0.8molH2O,6min時生成0.7gH2。則6min內以CO表示的平均反應速率為___________(保留3位有效數字)。
CO(g)+H2(g),其平衡常數表達式為K=___________。一定溫度下,在2L盛有足量炭粉的恒容密閉容器中通入0.8molH2O,6min時生成0.7gH2。則6min內以CO表示的平均反應速率為___________(保留3位有效數字)。
(2)燃料氣(主要含N2和H2,還含有少量其他雜質)中的CO會使電極催化劑中毒,使用CuO/CeO2催化劑可使CO優先氧化而脫除。CeO2可由草酸鈰[Ce(C2O4)3]灼燒制得,反應的化學方程式為___________。在CuO/CeO2催化劑中加入不同的酸(HIO3或H3PO4),測得燃料氣中CO優先氧化的轉化率隨溫度的變化如下圖所示。
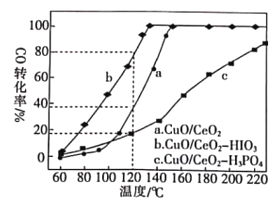
加入H3PO4___________(填“促進”或“抑制”)CuO/CeO2的催化。溫度為120℃,催化劑為CuO/CeO2-HIO3時,若燃料氣流速為1800mL·min-1,CO的體積分數為0.68%,則反應0.5h后CO的體積為___mL。
(3)LiOH是制備鋰離子電池正極材料的重要原料,利用LiCl溶液電解制備得LiOH的裝置如下圖,LiOH在___________(填“M極”或“N極”)制得,N極產生的氣體a通入淀粉KI溶液溶液變藍,持續一段時間后,藍色可逐漸褪去。據此寫出N極的電極反應式:__________,藍色逐漸褪去是因為溶液中逐漸生成HIO3,寫出此反應的化學方程式:______。
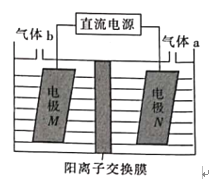
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三個密閉容器中分別充入N2、H2、O2三種氣體,以下各種情況下排序正確的是( )
A. 當它們的溫度和壓強均相同時,三種氣體的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 當它們的溫度和密度都相同時,三種氣體的壓強:p(H2)>p(N2)>p(O2)
C. 當它們的質量和溫度、壓強均相同時,三種氣體的體積:V(O2)>V(N2)>V(H2)
D. 當它們的壓強和體積、溫度均相同時,三種氣體的質量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,體積一定的密閉容器中發生如下可逆反應:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列說法正確的是
3Z(g) ΔH= QkJ/mol,下列說法正確的是
A. 消耗2 mol X同時生成3 mol Z,說明達到了平衡狀態
B. 加入少量的Y正反應速率加快
C. 氣體的密度不變時,說明達到了平衡狀態
D. 加入少量的X,Q變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:pOH=﹣lgc(OH﹣),298K時,向20.00mL0.10molL﹣1氨水中滴入0.10molL﹣1的鹽酸,溶液的pH和pOH與加入鹽酸體積關系如圖所示.下列說法正確的是
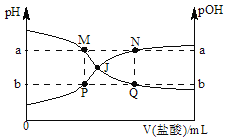
A. M、P兩點的數值之和a+b=14
B. M點水的電離程度比Q點大
C. 曲線PJN表示溶液中pH的變化
D. pH與pOH交叉點J對應的V(鹽酸)=20.00 mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,濃度均為 0.10 mol/L,體積均為 V0 的 MOH 和ROH 溶液,分別加水稀釋至體積 V,pH 隨![]() 的變化如圖所示。下列敘述正確的是
的變化如圖所示。下列敘述正確的是

A. 稀釋前兩溶液的 Ka : MOH 溶液>ROH 溶液
B. ROH 的電離程度:b 點小于 a 點
C. 兩溶液在稀釋過程中,c(H+)均逐漸減少
D. 當![]() 時,若兩溶液同時升高溫度,則c(R+)/c(M+)增大
時,若兩溶液同時升高溫度,則c(R+)/c(M+)增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]
技術人員曬制藍圖時,用K3Fe(C2O4)3]·H2O(三草酸合鐵酸鉀)作感光劑,再以K3[Fe(CN)6]氰合鐵酸鉀)溶液作顯影劑。請回答以下問題:
(1)鐵元素在周期表中位置為___________,Fe3+的基態價電子排布圖為___________。
(2)在上述兩種鉀鹽中第一電離能最大的元素為___________,電負性最小的元素為___________。
(3)H2C2O4分子屮碳原子的雜化類型是___________,與C2O42-互為等電子體的分子的化學式為___________(寫一種)。
(4)在分析化學中F-常用于Fe3+的掩蔽劑,因為生成的FeF63-十分穩定,但Fe3+卻不能與I-形成配合物,其原因是______________________(用離子方程式來表示)。
(5)已知C60分子結構和C60晶胞如右圖所示:
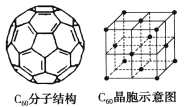
①1個C60分子中含有π鍵的數目為___________。
②晶胞中C60的配位數為___________。
③已知C60晶胞參數為apm,則該晶胞密度的表達式是___________g·cm-3(NA代表阿伏加德羅常數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com