
分析 (1)氯氣具有強氧化性,向盛有KI溶液的試管中加入少許CCl4后滴加氯水,CCl4層變成紫色,說明生成I2,繼續向試管中滴加氯水,振蕩,CCl4層會逐漸變淺,最后變成無色,說明I2被進一步氧化,生成HIO3,同時氯氣被還原為HCl,則碘元素化合價變化為:0→+5,氯氣中氯元素化合價變化為:0→-1,依據得失電子守恒、原子個數守恒配平方程式;
(2)根據化合價變化判斷氧化劑和還原劑;
(3)判斷反應中氧化性強弱,可根據化學方程式判斷:氧化劑+還原劑═還原產物+氧化產物;氧化性:氧化劑>氧化產物;還原性:還原劑>還原產物來分析.
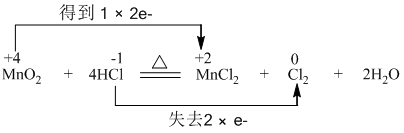
解答 解:①氯氣具有強氧化性,向盛有KI溶液的試管中加入少許CCl4后滴加氯水,CCl4層變成紫色,說明生成I2,繼續向試管中滴加氯水,振蕩,CCl4層會逐漸變淺,最后變成無色,說明I2被進一步氧化,生成HIO3,同時氯氣被還原為HCl,則碘元素化合價變化為:0→+5,氯氣中氯元素化合價變化為:0→-1,1mol碘單質反應失去10mol電子,1mol氯氣反應得到2mol電子,二者最小公倍數為10,依據氧化還原反應得失電子守恒,則氯氣系數為5,碘單質系數為1,依據原子個數守恒,方程式:I2+5Cl2+6H2O=2HIO3+10HCl;
故答案為:I2、5Cl2、6H2O、2HIO3、10HCl;
(2)在2KI+Cl2=2KCl+I2反應,I元素的化合價升高,被氧化,KI在反應中做還原劑,在5Cl2+I2+6H20=2HIO3+10HCl反應,I元素的化合價升高,被氧化,I2在反應中做還原劑.
故答案為:KI、I2;
(3)氯氣的氧化性比溴強,將KI換成KBr,則生成Br2,則CCl4層變為棕色,繼續滴加氯水,CCl4層的顏色沒有變化,說明氧化性HBrO3>Cl2,根據氧化劑和還原劑反應生成氧化產物和還原產物,氧化劑氧化性大于氧化產物的氧化性,
則有Cl2>HIO3,所以氧化性順序為HBrO3>Cl2>HIO3,
故答案為:棕;HBrO3>Cl2>HIO3.
點評 本考查氧化還原反應的配平、氧化劑和還原劑、氧化性強弱的判斷、化學計算知識.此題解答中用到了守恒法,守恒定律是自然界最重要的基本定律,是化學科學的基礎.在化學反應中,守恒包括原子守恒、電荷守恒、得失電子守恒等.比如此題中我們就牢牢抓住了守恒,簡化了計算過程,順利解答.


 開心蛙狀元測試卷系列答案
開心蛙狀元測試卷系列答案科目:高中化學 來源: 題型:解答題
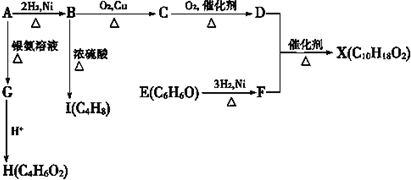
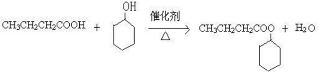 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
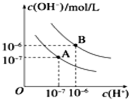 已知水在25℃和100℃時,其電離平衡曲線如圖所示:
已知水在25℃和100℃時,其電離平衡曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室制取乙炔時,用飽和食鹽水代替蒸餾水,以得到平穩的氣流 | |
| B. | 檢驗甲酸中是否混有乙醛,可向樣品中加入足量NaOH溶液以中和甲酸后,再做銀鏡反應實驗或與新制Cu(OH)2共熱的實驗 | |
| C. | 除去苯中的少量苯酚:加入適量NaOH溶液,振蕩、靜置、分液 | |
| D. | 液態溴乙烷中加入稀NaOH溶液共煮幾分鐘,然后加入稀硝酸酸化,再加入AgNO3溶液檢驗溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ④
④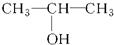 ⑤
⑤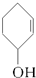 ⑥
⑥
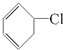 ⑧
⑧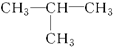 ⑨CH3-CH═CH2⑩
⑨CH3-CH═CH2⑩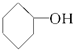 ⑪
⑪ ⑫CH3Cl
⑫CH3Cl查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | O2- Na+Mg2+Al3+ | B. | O Cl S P | ||
| C. | K+ Mg2+ Al3+ H+ | D. | A l3+Mg2+ Ca2+ F- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電子的能量越低,運動區域離核越遠 | |
| B. | 當M層是最外層時,最多可排布18個電子 | |
| C. | 稀有氣體元素原子的最外層都排有8個電子 | |
| D. | 核外電子的分層排布即是核外電子的分層運動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com