
| A. | 僅① | B. | 僅①② | C. | 僅①②③ | D. | ①②③④ |
分析 Na2S是強堿弱酸鹽,硫離子水解導致溶液呈堿性,且硫離子第一步水解程度遠遠大于第二步水解程度,該溶液中存在電荷守恒和物料守恒,根據電荷守恒和物料守恒判斷離子濃度大小.
解答 解:①Na2S是強堿弱酸鹽,硫離子水解導致溶液呈堿性,且硫離子第一步水解程度遠遠大于第二步水解程度,硫離子兩步水解和水電離都生成氫氧根離子,硫離子第一步水解生成硫氫根離子,所以該溶液中離子濃度大小順序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故正確;
②該物質溶液中存在電荷守恒,根據電荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故正確;
③根據物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故正確;
④根據物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),根據電荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故正確;
故選D.
點評 本題考查離子濃度大小比較,為高頻考點,明確鹽的類型及水解程度是解本題關鍵,注意電荷守恒和物料守恒的靈活運用,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 若X的反應速率為0.2 mol•L-1•s-1,則Z的反應速率為0.3 mol•L-1•s-1 | |
| B. | 若向容器中充入氦氣,壓強增大,Y的轉化率提高 | |
| C. | 升高溫度,正反應速率減小,平衡向逆反應方向移動 | |
| D. | 開始充入容器中的X、Y物質的量之比為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 (R、R′代表烴基)
(R、R′代表烴基)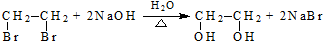 .
. .
.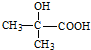 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,對正反應的反應速率影響更大 | |
| B. | 增大壓強,對正反應的反應速率影響更大 | |
| C. | 減小反應物濃度,對逆反應的反應速率影響更大 | |
| D. | 加入催化劑,對逆反應的反應速率影響更大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com