
分析 (1)化學方程式為:2FeCl3+Cu=2FeCl2+CuCl2 ,結合化學方程式定量關系計算得到;
(2)三價鐵離子的實驗驗證方法和現象分析,鐵離子結合硫氰酸根離子形成血紅色溶液;
(3)①若測定過程中碘量瓶敞口置于暗處5min,空氣中氧氣氧化碘離子為碘單質,消耗標準溶液物質的量增大;
②定量關系得到,2Cu2+~I2~2S2O32-,據此計算;
解答 解:(1)依據反應2FeCl3+Cu=2FeCl2+CuCl2,溶解電路板上3.2g的銅物質的量=$\frac{3.2g}{64g/mol}$=0.05mol,反應消耗氯化鐵0.1mol,溶液體積V=$\frac{0.1mol}{1mol/L}$=0.1L=100ml,
故答案為:100;
(2)驗證廢液中是否存在Fe3+的試劑是KSCN溶液,溶液呈血紅色證明是含有鐵離子,
故答案為:KSCN溶液;
(3)①若測定過程中碘量瓶敞口置于暗處5min,空氣中氧氣氧化碘離子為碘單質,消耗標準溶液物質的量增大,會導致測定結果偏高,
故答案為:偏高;
②依據反應的定量關系得到,2Cu2+~I2~2S2O32-,
20.00mL中:n(Cu2+)=n(S2O32-)=0.1000 mol•L-1×0.0200L=0.002mol,
銅元素的含量為$\frac{0.002mol×64g/mol}{0.02L}$×100%=6.4 g/L,
答:定量關系得到,2Cu2+~I2~2S2O32-,
20.00mL中:n(Cu2+)=n(S2O32-)=0.1000 mol•L-1×0.0200L=0.002mol,
銅元素的含量為$\frac{0.002mol×64g/mol}{0.02L}$×100%=6.4 g/L,該腐蝕液中銅元素的含量為6.4 g/L.
點評 本題考查了鐵及其化合物性質的應用、滴定實驗的定量計算、實驗驗證離子性質,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 1 mol稀硫酸和1 mol稀Ba(OH)2溶液完全中和所放出的熱量為中和熱 | |
| B. | 中和反應都是放熱反應,多數分解反應是吸熱反應 | |
| C. | 在101 kPa時,1 mol碳燃燒所放出的熱量一定是碳的燃燒熱 | |
| D. | 碳與二氧化碳的反應既是放熱反應,也是化合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀態下,22.4LSO3含有原子數為4NA | |
| B. | 4℃時,18gH2O含有2NA 個非極性鍵 | |
| C. | 1molNa2O和Na2O2混合物中含有的陰、陽離子總數是3NA | |
| D. | 將含1molFeCl3的飽和溶液滴入沸水形成的膠體粒子的數目為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
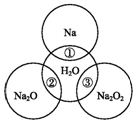 如圖兩圓圈相交的部分表示圓圈內的物質相互發生的反應.已知鈉及其氧化物的物質的量均為0.1mol,水的質量為100g.下列說法正確的是( )
如圖兩圓圈相交的部分表示圓圈內的物質相互發生的反應.已知鈉及其氧化物的物質的量均為0.1mol,水的質量為100g.下列說法正確的是( )| A. | 反應③最多能產生0.1 mol O2 | |
| B. | 反應①的離子方程式為Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中陰陽離子數目之比為1:1 | |
| D. | ①②③充分反應后所得溶液中溶質的質量分數:②=③>① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在粗鹽提純中,當加熱到蒸發皿中有較多固體析出,殘留少量液體時,停止加熱,用余熱將液體蒸干 | |
| B. | 當振蕩分液漏斗中的混合溶液時,須用一只手壓住分液漏斗的玻璃塞,另一只手握住旋塞,將分液漏斗倒轉過來,用力振蕩 | |
| C. | 粗鹽提純得到精鹽的過程一定需要兩次過濾操作 | |
| D. | 實驗過程中若皮膚不慎沾上少量堿液,應先用大量水沖洗,再用2%醋酸溶液或飽和硼酸溶液洗,最后用水沖洗 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
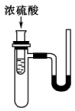 如圖小試管中盛有幾毫升水,與大試管連通的U形管內放有少量水(已染成紅色).如沿小試管壁慢慢注入3mL濃硫酸,靜置后,U形管中可觀察到的現象是液面( )
如圖小試管中盛有幾毫升水,與大試管連通的U形管內放有少量水(已染成紅色).如沿小試管壁慢慢注入3mL濃硫酸,靜置后,U形管中可觀察到的現象是液面( )| A. | 左高右低 | B. | 左低右高 | C. | 左右一樣高 | D. | 來回振動 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
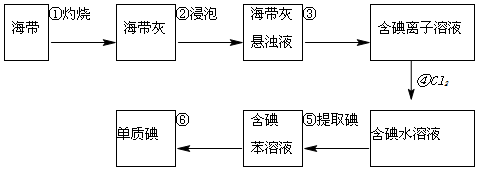 請填寫下列空白:
請填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 實驗操作及現象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液變無色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸餾水,溶液顏色變淺 |
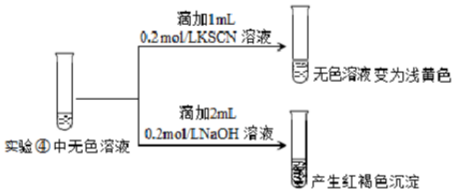
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com