
濃度/mol?L-1 / 時間/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
| c(N2)c(CO2) |
| c2(NO) |
| 0.03×0.03 |
| 0.04 |
| c(N2)c(CO2) |
| c2(NO) |
| 0.034×0.017 |
| 0.0322 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:閱讀理解
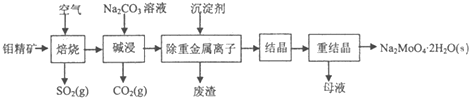
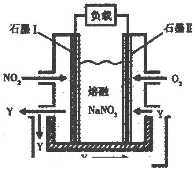
查看答案和解析>>
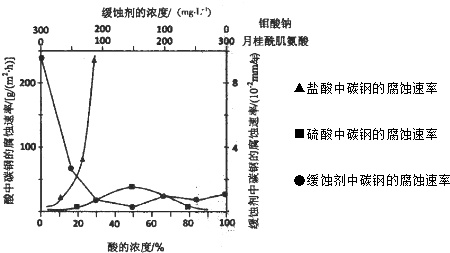
科目:高中化學 來源: 題型:閱讀理解
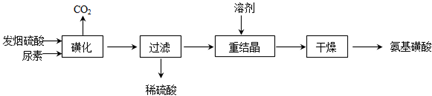
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2011?南京三模)核能源已日益成為當今世界的主要能源.
(2011?南京三模)核能源已日益成為當今世界的主要能源.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com