
【題目】用50mL 0.50 mol/L 的鹽酸與50 mL 0.55mol/L的氫氧化鈉溶液使用使用如下裝置進行中和熱測定實驗。
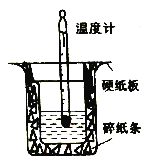
(1)裝置中缺少的一種儀器是_____,裝置中還存在的錯誤有_______,這種錯誤會造成最高溫度讀教_______(填“偏大”、“偏小”或“無影響”) 。
(2)可否取用55mL 0.50mol/L , NaOH 溶液種代50 mL 0.55m 訓L 的氫氧化鈉溶液?____(填“可用”或“不可以”)
(3)該實驗小組做了三次實驗,每次取溶液各50mL,并記錄如下原始數據。
實驗序號 | 起始溫度t1/℃ | 終止溫度(t2)℃ | 溫差(t2-t1)℃ | ||
鹽酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 28.2 | ||
2 | 25.1 | 25.1 | 28.4 | ||
3 | 25.1 | 25.1 | 28.5 | ||
已知鹽酸、NaOH溶液密度近似為1.0g/cm3,中和后混和液的比熱容 C=4.2J/(g·℃)列式并計算則該反應的中和熱為△H=_____________________;(計算結果保留小數點后1位)
【答案】 環形玻璃攪拌棒 大小燒杯口未平齊 偏小 可以 ![]() KJ/mol=-55.4KJ/mol
KJ/mol=-55.4KJ/mol
【解析】(1)裝置中缺少的一種儀器是環形玻璃攪拌棒,裝置中還存在的錯誤有大小燒杯口未平齊,這種錯誤會造成能量散失,導致最高溫度讀教偏小;
(2)中和熱與使用酸或堿的量多少無關,本題只有堿的總量大于HCl的物質的量,確保鹽酸完全反應即可,則可以用55mL 0.50mol/L NaOH 溶液代替50 mL 0.55mol/L 的氫氧化鈉溶液;
(3)第1次實驗反應前后溫度差為:3.2℃;第2次反應前后溫度差為:3.3℃;第3次實驗反應前后溫度差為:3.4℃,均有效,平均值為3.3℃,
0.55mol/L的NaOH溶液50mL與0.50mol/L的鹽酸50mL的質量和m=100mL×1g/mL=100g,c=4.2J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出熱量Q=4.2J/(g℃)×100g×3.3℃=1386J=1.386KJ,即生成0.025mol的水放出熱量1.386KJ,所以生成1mol的水放出熱量為![]() =55.4kJ,即該實驗測得的中和熱△H=-55.4kJ/mol;
=55.4kJ,即該實驗測得的中和熱△H=-55.4kJ/mol;


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】在體積為V L的恒容密閉容器中盛有一定量H2,通入Br2(g)發生反應H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。當溫度分別為T1、T2,平衡時,H2的體積分數與Br2(g)的物質的量變化關系如圖所示。下列說法正確的是
2HBr(g);ΔH<0。當溫度分別為T1、T2,平衡時,H2的體積分數與Br2(g)的物質的量變化關系如圖所示。下列說法正確的是

A.若b、c兩點的平衡常數分別為K1、K2,則K1>K2
B.a、b兩點的反應速率:b>a
C.為了提高Br2(g)的轉化率可采取增加Br2(g)通入量的方法
D.b、c兩點的HBr的體積分數b>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂燃料電池作為一種高能化學電源,具有比能量高、使用安全方便、成本低、燃料易于貯運、污染小等特點,擁有良好的應用前景。如圖是鎂燃料電池的一種原理圖,該裝置為圓筒狀,其中心為鎂柱,圓筒為可透氣的導電材料。下列有關該鎂燃料電池的敘述正確的是
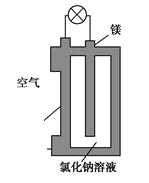
A. 該電池的總反應為2Mg+O2=2MgO
B. 反應生成O2-,該離子有正極移向負極
C. Cl-在陽極失去電子生成Cl2
D. 正極反應式為O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關水在人體中的作用,下列說法中正確的是 ( )
A、水不是一種很好的溶劑 B、水在人體內還有調節體溫的作用
C、飲用水越純凈越好 D、沒有污染的水就是純凈水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請回答下列問題:
(1)純水在T ℃時pH=6,該溫度下1 mol/L的NaOH溶液中,由水電離出的c(OH-)= mol/L。
(2)某一元弱酸溶液(A)與二元強酸(B)的pH相等。若將兩溶液稀釋相同的倍數后,pH(A) pH(B) (填“>”、“=”或“<”);現用上述稀釋溶液中和等濃度等體積的NaOH溶液,則需稀釋溶液的體積V(A) V(B)(填“>”、“=”或“<”)。
(3)已知:二元酸H2R 的電離方程式是:H2R=H++HR﹣,HR﹣![]() R2﹣+H+,若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1,則0.1molL﹣1H2R溶液中c(H+) (0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 。
R2﹣+H+,若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1,則0.1molL﹣1H2R溶液中c(H+) (0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 。
(4)電離平衡常數是衡量弱電解質電離程度的物理量。已知:
化學式 | 電離常數(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH[] | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃時,有等濃度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的順序為________(用化學式表示)。
②向NaCN溶液中通入少量的CO2,發生反應的化學方程式為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于現在的長式元素周期表的說法中正確的是( )
A.從左向右數第六縱行是ⅥA族
B.七個周期18個族
C.ⅠA族全部是金屬元素
D.所含元素種類最多的族是ⅢB族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸亞鐵(FeCO3)是菱鎂礦的主要成分,將FeCO3加熱到200℃開始分解為FeO和CO2,若在空氣中高溫煅燒FeCO3生成Fe2O3。
I.已知25℃,101kPa時:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)請寫出FeCO3在空氣中煅燒生成Fe2O3的熱化學方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定條件下被還原為金屬鐵。
(2)據報道一定條件下Fe2O3可被甲烷還原為“納米級”的金屬鐵。其反應為:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序數為26的鐵元素位于元素周期表的第_______周期。
②反應在5L的密閉容器中進行,2min后達到平衡,測得Fe2O3在反應中質量消耗4.8g。則該段時間內用H2表達的平均反應速率為____________。
③將一定量的Fe2O3(s)和一定量的CH4(g)置于恒溫恒壓容器中,在一定條件下反應,能表明該反應達到平衡狀態的是___________。
a.CH4的轉化率等于CO的產率 b.混合氣體的平均相對分子質量不變
c.v正(CO):v逆(H2)=1:2 d.固體的總質量不變
(3)FeO可用CO進行還原,已知:t℃時,FeO(s)+CO(g)![]() Fe(s)+CO2(g),K=0.5,若在1L密閉容器中加入0.04mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)的轉化率為50%,則x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密閉容器中加入0.04mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)的轉化率為50%,則x=_______。
Ⅲ. Fe2O3還可用來制備FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O![]() Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反應的平衡常效K1、K2、K3由大到小的順序是_______。通過控制條件,以上水解產物聚合生成聚合物的離子方程式為:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移動可采用的方法是__________(填字母)
a.加水稀釋 b.加入少量NaCl固體 c.升溫 d.加入少量Na2CO3固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用固體NaOH配制物質的量濃度溶液時,下列操作會導致溶液濃度偏高的是( )
A. 在燒杯中溶解時,有少量液體濺出 B. 樣品中含有少量Na2O雜質
C. 容量瓶使用前未干燥 D. 定容時仰視視容量瓶刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組為研究金屬的腐蝕與防護,設計如圖所示裝置。下列敘述不正確的是:

A.若X為碳棒,為減緩鐵的腐蝕,開關K應置于N處
B.若X為碳棒,開關K置于M處,會加快鐵的腐蝕
C.若X為鋅,開關K置于M處,就是犧牲陽極的陰極保護法
D.若X為鋅,開關K置于N處,鐵電極發生的反應為Fe-2e- =Fe3+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com